De Gids. Jaargang 38
(1874)– [tijdschrift] Gids, De–
[pagina 243]
| |
De scheikunde bij het middelbaar onderwijs.Dr. J.E. Enklaar, Leerboek der anorganische Scheikunde, op proefondervindelijken grondslag. Deventer, Jac. van der Meer, 1873.Zoo het eene onaangename bezigheid is het eind-examen der hoogere burgerscholen af te leggen, dat examen af te nemen kan moeielijk aangenamer taak zijn. Vele candidaten te examineeren zonder hen te ergeren en zich over hen te ergeren zal wel altijd een onbereikbaar ideaal blijven. Te examineeren in de warme Juli-maand, als het uur der vrijheid voor zooveel anderen slaat, is een werk, dat zijne minder aangename zijde zou hebben, ook wanneer de uitslag van het examen alleen aanleiding gaf tot opwekkende beschouwingen. Maar in dien tijd van het jaar, en zoo lang te examineeren, en zooveel stof tot aanmerkingen te vinden, als de commissie's ter afneming van de eind-examens gewoonlijk doen, is eene pijniging, die eenige overeenkomst heeft met de kwalen van Tantalus en van Sisyphus beide. Ook voor die beklagenswaardige commissie's ontbreken de lichtpunten niet geheel en al. Wel maakt de groote omvang van het examen het bijna onvermijdelijk, dat ieder candidaat in enkele vakken een ‘minder bevredigend’ examen doet. Wel schijnt er op sommige vakken een fatum te rusten, waardoor de vorderingen van een groot deel der candidaten in die vakken als ‘onvoldoende’ moeten veroordeeld worden. Maar er laten zich toch ook andere onderwerpen noemen, die door de leerlingen met zooveel lust en ijver beoefend worden, dat de gevreesde commissie's in den regel tevreden zijn. Tot die onderwerpen behoort de scheikunde. Zelfs Dr. Naber, die zooveel moeite gedaan heeft om uit de verslagen der commissie's voor | |
[pagina 244]
| |
de eind-examens te bewijzen, dat hij een profetischen geest had, toen hij reeds voor acht jaren voor het middelbaar onderwijs waarschuwde - zelfs Dr. Naber heeft niets anders te zeggen, dan dat ‘de beoefening der scheikunde scheen te wenschen over te laten in Noord-Holland, Friesland en Groningen’. Voor den oplettenden lezer ligt in die woorden de uitspraak opgesloten, dat het oordeel der commissie's over 't algemeen gunstig moet geweest zijn. Wie de verslagen der commissie's in de verschillende jaren nagaat, vindt dan ook, dat die uitspraak waarheid bevat. Dat Dr. Naber haar niet opzettelijk vermeldt, maar den lezer overlaat haar tusschen de regels te lezen, is waarschijnlijk toe te schrijven aan de omstandigheid, dat hij alleen verstaan wilde worden door zeer nadenkende en zeer oplettende lezers. Dat het onderwijs in de scheikunde aan de hoogere burgerscholen goede resultaten zou geven, was zeker niet voorzien door ieder, die de scheikunde kent. Van menig wetenschappelijk man heb ik de opmerking gehoord, dat het onmogelijk moest zijn aan jongens belangstelling in te boezemen voor eene zoo droge wetenschap als de scheikunde. Zij mist de aantrekkelijkheid die de mathesis, de mechanica, en tot op zekere hoogte ook de physica voor de kleinste helft der leerlingen hebben. Het aaneenschakelen van redeneeringen, waardoor men uit gegeven stellingen eene reeks van gevolgen afleidt, komt toch in de scheikunde weinig te pas. En zij mist evenzeer de aangename zijde, die de studie der natuurlijke historie voor de meeste jonge lieden vertoont, en die hierin bestaat, dat deze wetenschap zich alleen bezig houdt met zichtbare dingen. Wel is waar hebben de scheikundige werkingen zichtbare verschijnselen ten gevolge, maar juist die zichtbare verschijnselen zijn niet het eigenlijke onderwerp van de scheikunde. Die wetenschap bespreekt alleen de onwaarneembare werkingen, waarvan die zichtbare verschijnselen de gevolgen zijn. Daarom is zij abstract, even als de wiskunde en de natuurkunde, schoon niet in zoo hoogen graad. Maar haar ontbreken de voordeelen dier abstracte wetenschappen, het afleiden van een tal van bijzonderheden uit weinige algemeene stellingen. Menigeen zal zich dan ook herinneren, welk eene overwinning hij op zich zelven heeft moeten behalen, voordat hij eene ernstige poging waagde om een overzicht te verkrijgen van hare meest belangrijke feiten, en voordat hij zijne aandacht kon wijden aan de rudimenten van hare theorie, waarvan inconsequentie en tegenstrijdigheid de hoofdelementen schenen te zijn. | |
[pagina 245]
| |
De personen, die zoo oordeelden, hadden in hunne waardeering van de scheikunde niet geheel ongelijk, maar zij gingen uit van de meening, dat het onderwijs in die wetenschap op de middelbare school zou geschoeid moeten worden op de leest van het hooger onderwijs. Bij dit laatste begint men dadelijk, of bijna dadelijk, met de uiteenzetting en toelichting van de zeer abstracte theorie, die bij alle wetenschappelijke beschouwingen van de tegenwoordige scheikundigen ondersteld wordt. Daarop laat men een systematisch overzicht volgen, waarin de physische eigenschappen en het chemisch karakter der elementen en hunner belangrijkste verbindingen besproken worden. Men onderwijst in één woord de wetenschap volgens de synthetische methode. Uitgaande van de meest algemeene beginselen, waartoe het voortgezet onderzoek geleid heeft, daalt men van deze af tot minder algemeene stellingen, om eindelijk te komen tot de verklaring van het bijzondere, wat de natuur ons uitsluitend toont. Bij de synthetische behandeling van de scheikunde moet de atoomtheorie het eerste onderwerp zijn, dat besproken wordt. Dan volgt de studie der elementen en die van hunne verbindingen, eerst de meer eenvoudige, later de meer samengestelde. Die methode draagt ons de wetenschap voor in den welgeordenden toestand, waarin zij zich behoort te bevinden in het hoofd, dat haar machtig is. Zij deelt den leerling geen enkel feit mede, zonder hem tevens de verklaring van dat feit te geven, voor zoover die bekend is. Om beide redenen is zij voor oudere personen, die zelfbedwang genoeg bezitten om veel tijd en moeite te geven aan studiën, die op zich zelve niet aangenaam zijn en wier nut niet rechtstreeks in het oog valt, de eenige methode, die op den duur bruikbaar is. Misschien is het echter ook voor zulke beoefenaars der scheikunde niet kwaad, als eene andere behandelingswijze den cursus opent, en hen reeds van verre een uitzicht geeft op het einddoel, waartoe hunne tijdroovende studiën moeten leiden. Het kan toch gebeuren, dat de leerling, die volgens de synthetische methode in de scheikunde wordt binnengeleid, maanden lang voortwerkt voordat hij de verklaring verneemt van een der scheikundige werkingen, die hij vroeger in de natuur heeft waargenomen. Gedreven door den lust om kennis te maken met eene nieuwe natuurwetenschap, heeft hij verwacht, dat die wetenschap hem iets nieuws zou leeren over de natuur, die hij vroeger kende. Doch hij ziet zich aanvankelijk rondgeleid in eene wereld, die wel in zekeren zin tot de natuur be- | |
[pagina 246]
| |
hoort, maar die toch eerst door menschelijke kunst bij de hem vroeger bekende natuur gevoegd is. Hij verneemt het een en ander over waterstof, over chloor, over bromium, altemaal stoffen, waarvan hij erkennen moet dat zij te bereiden zijn uit natuurproducten, en dat zij werkelijk de eigenschappen bezitten, die de docent zoo zorgvuldig opsomt. Maar van de scheikundige geschiedenis van die natuurproducten weet hij nog niets, en hij ziet volstrekt niet in, waartoe die conscientieuse optelling van de eigenschappen der elementen eigenlijk moet dienen. Hij wil den leeraar gaarne gelooven, als deze hem vertelt, dat een liter chloor zoo en zoo zwaar is, dat chloor oplosbaar is in water, dat het niet brandt, enz. Hij heeft er zoo weinig bezwaar in deze waarheden te erkennen, dat hij het eenigszins vreemd vindt, dat de leeraar ze hem maar niet eenvoudig mededeelt, en er eenig gewicht aan schijnt te hechten ze hem zelf te laten zien. Maar het is hem lang niet duidelijk, hoe al deze onbetwijfelbare waarheden in betrekking staan tot de kennis van de natuur, die ieder mensch omringt. Het kan zelfs gebeuren, dat hij begint te vermoeden, dat de scheikunde niet handelt over die natuur, maar over eene andere, die alleen in de chemische laboratoria te vinden is. Zulk eene behandeling van de scheikunde zou zeker bij de jeugd op de middelbare scholen weinig sympathie wekken. Een zuiver synthetisch onderwijs in de scheikunde is op de hoogere burgerschool reeds hierom onmogelijk, omdat de leerlingen, die den cursus over scheikunde beginnen, volmaakt ongeschikt zijn om zich bezig te houden met zoo abstracte begrippen als de atomen en de moleculen der hedendaagsche scheikunde. Bij het begin van den cursus moet de leeraar aan de leerlingen een zeker aantal scheikundige verschijnselen laten zien. Dan moet hij hunne aandacht vestigen op de onzichtbare veranderingen, die bij eene scheikundige werking de zichtbare veranderingen der stof begeleiden. Zoo moet hij hen brengen tot het vormen van de begrippen van verbinden en ontleden, van samengestelde stof en element. Daarna moeten die begrippen toegepast worden op een aantal scheikundige verschijnselen, waarbij de leeraar van het eenvoudige tot het meer samengestelde opklimt, en den leerling in de gelegenheid stelt de begrippen van substitutie, dubbele ontleding, zuur, basis, zout, radicaal, enz. met de zichtbare verschijnselen of voorwerpen te verbinden, die voor de wetenschap de aanleiding geweest zijn om die begrippen te vormen. | |
[pagina 247]
| |
Dan eerst is de tijd gekomen, waarop de leerling Dalton's atoom-theorie en hare toepassing kan begrijpen. Dan eerst bestaat er kans hem te doen inzien, dat het spreken over atomen en moleculen niet eene onbegrijpelijke monomanie der scheikundigen is, maar dat de waarneembare feiten hen met onweerstaanbare kracht tot zulke begrippen drijven. Trouwens, de vraag, hoe men het betrekkelijk gewicht van die hypothetische atomen en moleculen bepaalt, blijft ook dan voor den leerling een ondoorgrondelijk raadsel, waarover de leeraar wel zeer wetenschappelijk kan spreken, maar waarbij de scholieren hem niet kunnen volgen. Maar de leerling kan ten minste met juistheid vatten wat men met de woorden atoom en molecule bedoelt. Hij kan in het vervolg het teekenschrift gebruiken, dat de duidelijke voorstelling en het onthouden van scheikundige reactie's zoo veel gemakkelijker maakt. Maar hij moet zijne kennis van scheikunde en natuurkunde nog vrij wat uitbreiden, voordat hij komen kan tot de beoefening van het onderwerp, waarmede eene synthetische behandelingswijze van de scheikunde begint, eene nauwkeurige schets van de chemische theorie. Volgens deze laatste beginselen is het leerboek der anorganische scheikunde bewerkt, waarin Dr. Enklaar het bekende boek van Dr. ArendtGa naar voetnoot1 van verre gevolgd heeft. Hij heeft zijn onderwerp willen behandelen volgens de ‘heuristische methode’, wier belangrijkste kenmerk hij daarin zoekt, dat de leerling zelf uit de ‘leerstof’, die de leeraar voordraagt, de hoofdbegrippen afleidt, waarvoor die stof de gegevens levert. Ik geloof met hem, dat alleen zulk eene behandeling van de scheikunde bij het middelbaar onderwijs op hare plaats is. Als men de groote massa der geleerdheid overziet, waarin de leerlingen der middelbare scholen onderwijs ontvangen, dan begrijpt men en waardeert men de ongerustheid van vele welwillende vrienden der jeugd, die eene ernstige vrees koesteren voor de gezondheid der jeugdige hersenen. Die welwillende vrienden verkeeren toch in den waan, dat de jeugdige hersenen al de geleerdheid moeten weten, die op het programma voorkomt. En het is niet onmogelijk, dat sommige onverstandige vrienden van het Middelbaar Onderwijs, misschien ook wel sommige leeraren of leden van examen-commissiën, hun aanleiding gegeven hebben tot die vrees. Wie | |
[pagina 248]
| |
echter de zaak ernstig overdenkt, moet inzien, dat de bedoeling van het middelbaar onderwijs niet zijn kan den leerling te voorzien van de nuttige kennis, die hij in zijn volgend leven zal kunnen gebruiken. Want er is geen vak te noemen, dat niet aan dezen of genen mensch te pas komt. Hoe uitgebreid het programma der hoogere burgerscholen ook zijn moge, als die scholen aan de leerlingen al de waarheden moesten mededeelen, die zij in hun volgend leven kunnen noodig hebben, dan zou dat programma nog veel te beperkt zijn. De vakken, waarin onderwijs gegeven wordt, moeten voor den leeraar niets anders zijn dan de middelen, waardoor hij den leerling oefent in eigen werkzaamheid, in het zien met eigen (lichamelijke) oogen, in het denken met eigen hersenen. Kent de leerling aan het einde van den cursus weinig waarheden, maar is hij krachtig vooruitgegaan in de drie genoemde bekwaamheden, die waarschijnlijk bedoeld worden, als men van ‘algemeene ontwikkeling’ spreekt, dan mag men hem geluk wenschen met zijn welbesteden tijd. Wie heeft leeren studeeren, leeren waarnemen, leeren denken, kan zelf alle waarheden en alle feiten vinden, die hij op zijn levensweg noodig heeft. Daarom moet ook de leeraar in de scheikunde het eene zaak van ondergeschikt belang achten, of de leerlingen wat meer of minder feiten kennen, en of hunne kennis van de scheikunde in eenigszins hoogere mate onvolledig is dan zij uit den aard der zaak op de middelbare school altijd blijven moet. Zijn onderwijs behoort, even als dat van alle andere leeraren, voornamelijk te dienen om den leerling de gelegenheid te geven om te werken, te zien, te denken. Dat hij scheikundige waarheden moet mededeelen, dat hij de leerlingen een blik moet doen slaan op de eigenaardigheden van chemische onderzoekingen, is niet het wezenlijk karakter van zijn onderwijs; het is niets meer dan eene bijkomende omstandigheid. Hoe zal men nu het onderwijs in de scheikunde zoo inrichten, dat zijn hoofdkenmerk niet bestaat in de mededeeling van scheikundige waarheden, maar in eene opleiding van den leerling tot werken, waarnemen en denken? Zeker niet door eene synthetische behandeling, waarbij men de wetenschap voordraagt in den vorm, waarin zij zich thans in de hoofden van hare beste vertegenwoordigers geordend heeft. Want men behoeft wel niet zelf een dier uitstekendste vertegenwoordigers te zijn, maar men moet toch eene uitgebreide kennis van de scheikunde bezitten, | |
[pagina 249]
| |
om de redenen in te zien, waarom juist die bepaalde opvattingswijzen ingang gevonden hebben, die men thans aanneemt. Die redenen leert men alleen kennen door de historie der wetenschap. Geloovig aan te nemen, dat alles in de hedendaagsche scheikundige theorie onbetwistbare waarheid, en niets dwaling is, moge eene zeer voortreffelijke handelwijze zijn voor iemand, die langs den kortst mogelijken weg de scheikunde wil leeren kennen, om haar practisch te gebruiken. Maar op de middelbare scholen, waar de scheikunde een middel ter opvoeding en ontwikkeling zijn moet, slaat men den verkeerden weg in, zoo dikwijls men verlangt, dat de leerlingen iets zullen aannemen, waarvan zij niet erkennen moeten, dat het hoogstwaarschijnlijk zoo en niet anders is. Niets is meer doodend voor het eigen denken dan het opgedrongen geloof aan beweringen, voor wier waarschijnlijkheid men geen enkelen grond kan ontdekken. Niets is heilzamer ter bevordering van het eigen denken dan met helder bewustzijn de redeneeringen te maken, waardoor de natuurkundigen uit de bijzondere verschijnselen de zeer algemeene en zeer abstracte stellingen hebben afgeleid, die bij eene synthetische behandeling als de eerste beginselen van de wetenschap worden vooropgesteld. Hoe heilzaam die methode ook zijn moge, voor den leeraar in de scheikunde biedt zij eigenaardige en groote bezwaren. De jongste omwenteling in de scheikundige theorieën, die aan redeneering en bespiegeling eene zoo ruime plaats geschonken heeft in eene wetenschap, welke zich vroeger zoo angstvallig aan het zinnelijk waarneembare vastklemde, maakt het geven van een ‘heuristisch’ of ‘analytisch’ middelbaar onderwijs in de scheikunde tot eene uiterst moeielijke onderneming. Er zijn gewichtige gronden aan te voeren voor de meening, dat die methode bij den tegenwoordigen toestand der scheikunde, op die wetenschap even weinig toepasselijk is als op de mechanicaGa naar voetnoot1. | |
[pagina 250]
| |
Maar terwijl de mechanica, synthetisch behandeld, een uitmuntend middel is om de leerlingen te oefenen in het maken van abstracte redeneeringen, wier onderwerp eenvoudig genoeg is om door hen begrepen te worden, in het toepassen van algemeene stellingen op bijzondere gevallen, in het vinden van den algemeenen regel, waaronder het bijzonder geval behoort, heeft de scheikunde al deze voordeelen slechts in veel geringer graad en alleen voor personen, die meer scheikundige feiten kennen, dan men van het gros van de leerlingen der middelbare scholen kan verwachten. Daarom moet men óf de scheikunde analytisch behandelen, óf, als dit onmogelijk is, voorstellen haar zoo spoedig mogelijk van de lijst der vakken te doen verdwijnen en in afwachting daarvan de uren verminderen, die men aan haar besteedt. Indien er voor het mondeling onderwijs in de scheikunde slechts drie of vier uren 's weeks in den geheelen cursus voorkwamen, zou men de klippen der abstracte theorie kunnen ontzeilen, en zich tevreden stellen met den leerling die scheikundige begrippen te geven, welke de kennis der atoomtheorie niet vooronderstellen. Maar nu er zeven of acht uur aan de scheikundige lessen gewijd worden, en nog twee of vier uren aan de practische lessen in het laboratorium, kan men zich niet tot eene zoo elementaire behandeling bepalen. De oude scheikundige theorie, die voor het elementaire onderwijs groote voordeelen aanbood, omdat zij zich gevormd had naar aanleiding van de allereenvoudigste chemische reactie's, die men zonder moeite aan de leerlingen kan laten zien, is onder het gewicht van hare inconsequenties en tegenstrijdigheden zoo onherroepelijk bezweken, dat het niet aangaat de leerlingen der middelbare school met haar bezig te houden. Nu er bijna geen scheikundige werken meer verschijnen, waarin die theorie gehuldigd wordt, laat het zich niet langer verdedigen de jeugd op die verouderde denkbeelden te onthalen. Voor eenige jaren achtte ik dit uit een didactisch oogpunt voorloopig nog niet zoo verwerpelijk als vele anderen. Maar ik erkende toen reeds, dat mijn standpunt slechts een voorloopig standpunt kon zijn, en thans komt het mij niet langer raadzaam voor dien weg te volgen. Hoe gaarne de leeraar ook aan zijne leerlingen van veertien of vijftien jaren de kennismaking met dergelijke abstracta als atomen en moleculen zou besparen, daar is nu eenmaal niet aan te doen, en hij moet zien, hoe hij zich er doorheen redt, zonder | |
[pagina 251]
| |
dat de leerlingen hem in stomme verbazing aanstaren, omdat zij niets begrijpen van de hooge wetenschap, die hij hun mededeelt, en zonder dat zij hem geloovig napraten, volslagen onbekend met de beteekenis der geleerde volzinnen, die hun zoo vlug van de tong rollen. Het schijnt, dat niet ieder die zaak zoo zwaar inziet, als de schrijver dezer bladzijden. Dat hij echter ook lotgenooten heeft, die het met hem eene zeer moeielijke zaak achten de leerlingen de hoofdbegrippen der atoom-theorie uit de verschijnselen te doen afleiden, blijkt uit de zorgvuldigheid en de uitvoerigheid, waarmede Dr. Enklaar dit gedeelte van zijne taak bewerkt heeft. Ook Gunning heeft ons in zijne ‘Beginselen der algemeene scheikunde’ getoond, dat hij eene studie van weken en maanden noodig acht, voordat de leerlingen zich aan die afleiding kunnen wagen. En dat werk is niet eens geschreven met het oog op het Middelbaar Onderwijs. Vele bijzonderheden bewijzen, dat Gunning zich lezers voorstelde, die ouder en meer ontwikkeld zijn dan de knapen, die op de middelbare school den cursus over scheikunde beginnen. Vestigen wij onze aandacht op de wijze, waarop Dr. Enklaar het moeielijkst gedeelte van zijne taak vervuld heeft. Eerst geeft hij een aantal voorbeelden, waaruit de leerling kan te weten komen, wat de scheikundige verstaat onder verbinding en ontleding, onder oxydatie en reductie, onder eene samengestelde stof en een element, onder chemische verwantschap. Behoudens enkele kleinigheden, die de moeite van het vermelden niet waard zijn, is er niets, dat mij in dit gedeelte misplaatst voorkomt, dan alleen de schets van de ‘methode der natuurwetenschap’, die reeds op blz. 25, en op eene halve bladzijde, gegeven wordt. Deze schets, die in een leerboek over logica op hare plaats zou zijn, is voor de leerlingen veel te geleerd, en hare vermelding te dier plaatse strijdt tegen de heuristische methode van den schrijver. ‘Heuristisch’ of ‘analytisch’ zal men toch de methode der natuurwetenschap wel alleen kunnen leeren kennen, door de verschillende deelen van die wetenschap te bestudeeren, maar niet door een enkel natuurverschijnsel, bijv. de oxydatie der metalen in de lucht, nader te leeren kennen en daarop de beschrijving te lezen van de methode, die de natuurwetenschap in 't algemeen volgt. Overgaande tot het tiende hoofdstuk, waarin de salto mortale naar de atomen en de moleculen zal gewaagd worden, stuiten wij weldra op eene onjuiste bewering, waarvoor echter niet Dr. | |
[pagina 252]
| |
Enklaar alleen aansprakelijk is, maar die tot de vooroordeelen behoort, wier verspreiding onder wetenschappelijke mannen zoo algemeen is, dat het onbeleefd is aan hunne waarheid te twijfelen. ‘Hij (Lavoisier) vestigde de aandacht op het hoogst belangrijk beginsel, dat de stof niet vernietigd kan worden. Hoewel deze waarheid ons tegenwoordig bijna een axioma schijnt te wezen, kostte het Lavoisier langen strijd vóór hij zijne tijdgenooten van de juistheid zijner stelling overtuigd had’. Wie de moeite neemt de zaak te onderzoeken, zal bevinden, dat de stelling ‘de substantie blijft onveranderd, en slechts de eigenschappen (accidentia) wisselen’, eene bewering is, die men niet alleen bij een tal van schrijvers vóór Lavoisier vermeld vindt, maar waaraan niemand ooit heeft kunnen twijfelen. Want onder de ‘substantie’ verstond men altijd juist het blijvende in de dingen, van welks bestaan wij overtuigd zijn, zonder dat de waarnemingen er ons eenig recht toe geven. En als de substantie van de stoffelijke dingen heeft men sedert Descartes algemeen de stof (materie) aangenomen. Het groote beginsel, dat Lavoisier het eerst ondersteld en aanvankelijk door de proef bevestigd heeft, is iets geheel anders. Het is zijne onderstelling, dat het gewicht eene blijvende en standvastige eigenschap der stof is. De vroegere scheikundigen zagen in het gewicht eene dergelijke wisselvallige hoedanigheid als de kleur is, die bij eene zelfde stof zeer verschillend kan zijn onder verschillende omstandigheden, die afhankelijk is van den graad van verdeeling, van de verlichting, enz. Na vermeld te hebben, dat Lavoisier de aandacht der scheikundigen op de wenschelijkheid van quantitatieve onderzoekingen gevestigd heeft, laat de schrijver de wet der standvastige verhoudingen volgen Daarna geeft hij op, hoeveel waterstof, koolstof, zwavel, kwik, enz. zich met 16 gewichtsdeelen zuurstof verbinden, en zegt vervolgens, dat juist dezelfde hoeveelheden waterstof, koolstof, kwik, enz. zich ook verbinden met 32 gewichtsdeelen zwavel, d.w.z. met ‘de hoeveelheid zwavel, welke zich met 16 gewichtsdeelen zuurstof vereenigt’. Ik ben te goed bekend met de bezwaren, waarop men stuit, als men dit onderwerp voor jeugdige toehoorders duidelijk wil uiteenzetten, om den schrijver hard te vallen, wanneer hij zich minder juist uitdrukt. Maar hij zal mij de opmerking ten goede houden, dat hij reeds hier, om door de leerlingen verstaan te worden, eens de helft van de waarheid verzwijgt en eens eene | |
[pagina 253]
| |
kleine onwaarheid mededeelt. Immers, 16 gewichtsdeelen zuurstof verbinden zich niet alleen met 2 gewichtsdeelen waterstof, maar ook met 1 gewichtsdeel waterstof, niet alleen met 12 gewichtsdeelen koolstof, maar ook met 6. Dat er gewoonlijk meer dan eene verbinding van twee elementen bestaat, is opzettelijk verzwegen om de zaak eenvoudiger voor te stellen, dan zij werkelijk is. En wat de kleine onwaarheid betreft; er bestaat geen verbinding van 16 gewichtsdeelen zuurstof met 32 gewichtsdeelen zwavel, zooals de schrijver den argeloozen leerling wil doen gelooven. Wel zijn er verbindingen bekend van 16 gewichtsdeelen zuurstof met 16 gewichtsdeelen zwavel en met 10⅔ gewichtsdeelen zwavel. Dat weet Dr. Enklaar natuurlijk even goed als ik, maar hij moest het verzwijgen en iets anders zeggen, om het begrijpen van de regelmatigheid, die de gewichtsverhoudingen bij chemische werkingen vertoonen, voor zijne leerlingen niet te moeielijk te maken. Neemt men in aanmerking, dat er meer dan eene enkele verbinding van twee elementen bestaan kan, dan kan men niet zeggen, dat de hoeveelheden der elementen, die zich met 16 zuurstof verbinden, dezelfde zijn als de hoeveelheden, die zich met 32 zwavel verbinden, maar men komt tot een regel, wiens beteekenis men niet zonder veel moeite aan jongens van veertien of vijftien jaar zal doen begrijpen. In zijn algemeenen vorm wordt die regel wellicht nog het duidelijkst op de volgende wijze uitgedrukt: De hoeveelheden van twee elementen A en B (bijv. zuurstof en zwavel), die zich met dezelfde hoeveelheid van een derde element C (bijv. met 1 gewichtsdeel kalium) verbinden, zijn in 't algemeen niet aan elkander gelijk, maar staan in zekere verhouding p. De hoeveelheden van dezelfde elementen A en B., die zich met eene zelfde willekeurige hoeveelheid van eenig ander element D (bijv. met 1 gewichtsdeel natrium, baryum, enz.) verbinden, staan òf in de verhouding p, òf in de verhouding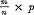 , waarin m en n kleine geheele getallen zijn. Wil men aan de leerlingen dezen regel besparen, die van hunne ongeoefende hersenen vordert, dat zij zich de voorstelling van ‘verhoudingen van verhoudingen’ vormen, dan moet men de zaak eenvoudiger voorstellen dan zij werkelijk is. Tot dit middel zagen wij dan ook Dr. Enklaar zijne toevlucht nemen. Ik durf niet in 't algemeen te beslissen of hij daaraan verkeerd doet. Maar dat hij reeds bij den aanvang tot zulke | |
[pagina 254]
| |
maatregelen genoodzaakt is, geeft ons eene kleine voorproef van de moeilijkheden, waarop hij later zal stuiten. De volgende stap, waardoor de schrijver zijn doel nadert, bestaat in de vergelijking der gewichten van gelijke gasvolumina van verschillende verbindingen. Dan stelt hij het gewicht van een cubieken decimeter waterstof gelijk 2, en vindt daardoor voor het gewicht van een cubieken decimeter van de verschillende verbindingen in den gastoestand de bekende cijfers, die men in de chemische handboeken voor de moleculairgewichten vindt opgegeven. Het komt mij twijfelachtig voor of de leerlingen wel weten wat zij doen, als zij den leeraar bij dezen stap volgen. Die leerlingen moeten natuurlijk weten, wat men door de dichtheid van een gas verstaat. Maar dit is geen onoverkomelijk bezwaar; men kan hen door sprekende proeven in de gelegenheid stellen dit te begrijpen. Doch, wat erger is, die leerlingen moeten ook weten, dat de dichtheid van een gas, en van een damp bij aanmerkelijk hoogere temperaturen dan het kookpunt, onder verschillende drukking en bij verschillende temperatuur even groot blijft, behoudens de kleine afwijkingen van deze wet, die elk gas en elke damp vertoont. De leeraar in de scheikunde of in de natuurkunde heeft hen duidelijk doen inzien, hoe de dichtheid van kooldioxyde of van waterstof bij normale temperatuur en drukking bepaald wordt. Hij heeft waarschijnlijk die bepaling, zoo nauwkeurig als het in eene les gedaan kan worden, voor hunne oogen verricht. Zij weten dan, wat het beteekent, als hij zegt, dat de dichtheid van kooldioxyde onder de gewone omstandigheden van temperatuur en spanning 1.529 is. Nu kan men echter niet al de gasvolumina bij de gewone temperatuur en spanning vergelijken. Om te vinden, dat de dichtheid van de waterdamp 0.625 is, kan men geen volumen waterdamp van 0o C. en 760 mm. drukking afwegen. Want waterdamp van 0o C. kan geen spanning hebben van 760 mm. Dat cijfer 0.625 wordt alleen verkregen door het gewicht van een volumen waterdamp van aanmerkelijk hoogere temperatuur dan het kookpunt bij de gegeven drukking te deelen door het gewicht van een gelijk volumen lucht van gelijke temperatuur en drukking. Daarom moet de leerling, die begrijpen zal, dat men ook de gewichten van dampvolumina met die van gasvolumina vergelijken kan, bekend zijn met de omstandigheid, dat de wetten van Boyle en van | |
[pagina 255]
| |
Gay-Lussac nagenoeg volkomen gevolgd worden door onverzadigde dampen. Om die omstandigheid te kennen, moet hij die twee wetten goed begrepen hebben, en weten wat onverzadigde dampen zijn. Maar die wetten en hunne toepassing op dampen kent hij niet, voordat hij de grootste helft van den tweeden cursus over natuurkunde achter den rug heeft, en misschien eerst veel later. Hoe helpt zich Dr. Enklaar uit deze moeilijkheid? Hij doet het voorkomen alsof men alle gassen en dampen vergeleek bij eene temperatuur van 0o C. Hij verzekert ons dat een cubieke decimeter waterdamp van 0o C. onder 760 mm. drukking 0.801 gram weegt, ofschoon hij natuurlijk wel weet, dat dit niet waar is. Ik wil er al weder geen aanmerkingen op maken. Want het is uiterst moeilijk jongens van veertien of vijftien jaren een helder inzicht te geven in de feiten, waarop de chemische theorie berust. Wil men dat doen, dan kan men haast niet vermijden de natuur wat eenvoudiger voor te stellen dan zij werkelijk is. Maar als nu de schrijver eens geïnterpelleerd wordt over zijn waterdamp van 0o door een van die denkende leerlingen, wier vragen zoo lastig kunnen zijn, wat zal hij dan antwoorden? Hoogst waarschijnlijk weet die leerling nog zeer weinig van natuurkunde en dan gelooft hij niet, dat waterdamp van 0o bestaan kan. Tracht men hem juister denkbeelden te geven, dan zal hij, als de leeraar daarin gelukkig geslaagd is, zonder moeite berekenen, dat de waterdamp, die bij 0o C. en 760 mm. drukking in een liter lucht kan voorkomen, veel minder weegt dan 0.801 gram., terwijl onvermengde waterdamp van 0o C. en 760 mm. drukking niet bestaan kan. Is er geen enkele leerling in de klasse, die zulke aanmermerkingen maakt, dan volgt er alleen uit, dat de geheele klasse niet wist wat zij deed, toen zij den leeraar op zijn weg volgde. Dan hebben de leerlingen niet begrepen wat de leeraar hun vertelde en wat zij hem in 't vervolg zullen navertellen. Na de cijfers vermeld te hebben, die het gewicht van een cubieken decimeter van verschillende verbindingen in gastoestand voorstellen, als het gewicht van een cubieken decimeter waterstof gelijk 2 gesteld wordt, berekent de schrijver de hoeveelheden van verschillende elementen, die in een cubieken decimeter hunner verbindingen (in gastoestand) voorkomen. Uit die berekening volgt, dat de waterstof in een cubieken decimeter van elke waterstofverbinding n × 1 weegt, waarin n een | |
[pagina 256]
| |
geheel getal is, de zuurstof in een cubieke decimeter van elke zuurstofverbinding n × 16, waarin n een geheel getal is, enz. Hiertegen is niets aan te merken, en geen leerling, die het voorgaande begrepen heeft, kan aarzelen den schrijver in die berekening te volgen en zich met hem te verheugen over de eenvoudige uitkomst. Thans moet echter weder eene kleine onjuistheid volgen. Om van de vergelijking der voluumgewichten tot de vergelijking der moleculairgewichten te komen, zou de wet van Avogadro besproken moeten worden. Deze wet, of juister uitgedrukt, deze ‘onderstelling’ zegt, dat in gelijke volumina van verschillende gassen en dampen, onder de omstandigheden, waarbij zij de wetten van Boyle en Gay-Lussac nauwkeurig opvolgen, het aantal moleculen gelijk is, wanneer de drukking en de temperatuur gelijk zijn. De schrijver heeft waarschijnlijk gemeend, dat het wat moeilijk voor de leerlingen zou zijn op deze hoogte van de redeneering hunne aandacht plotseling bij die wet te bepalen, welke met het voorgaande niets te maken heeft. De vernuftige wijze, waarop hij ook deze moeielijkheid ontzeilt, verdient bewondering, zelfs als men haar niet wil navolgen. ‘Noemen wij een cubieken decimeter van eene stof, in den gasvormigen toestand verkeerende (bij eene temperatuur van 0o en eene drukking van 760 mm.), het molecule van die stof, dan blijkt dat....’ Dan blijken natuurlijk verschillende dingen. Vooreerst wordt het moleculairgewicht van de gasvormige verbindingen en elementen dadelijk bekend. Ten tweede is het gemakkelijk in te zien, dat in het ‘molecule’ van elke waterstofverbinding n x 1/2 molecule waterstof, in het molecule van elke stikstofverbinding n x 1/2 molecule stikstof voorkomt, enz., waarin n een geheel getal is. Die halve moleculen waterstof en stikstof, waarvan er een geheel getal in het molecule van elke waterstofverbinding of van elke stikstofverbinding voorkomen, worden nu door den schrijver atomen genoemd. In het algemeen verstaat hij onder een atoom ‘de gewichtshoeveelheid van (een element), voorhanden in een molecule van eene verbinding, die er het minste van bevat’. De salto mortale is gelukkig volbracht; de schrijver heeft de moleculen en de atomen aan zijne leerlingen gepresenteerd. De kleine onjuistheid, waarop ik zooeven zinspeelde, bestaat | |
[pagina 257]
| |
natuurlijk hierin, dat de moleculen en atomen, die de schrijver invoert, niet zijn de moleculen en atomen van de hedendaagsche scheikunde, maar moleculen en atomen van zijn eigen maaksel. Zeer hinderlijk is die onjuistheid niet, mits de schrijver slechts consequent blijft, en voortaan altijd hetzelfde onder molecule en atoom verstaat. Maar het is duidelijk, dat hij niet consequent kan blijven. Noemt men een cubieken decimeter van eene stof in gasvormigen toestand het molecule van die stof, dan moet men zeggen, dat de zeer talrijke stoffen, die niet vluchtig zijn, geen moleculen hebben. De schrijver spreekt echter dikwijls van het molecule van dergelijke stoffen. Zoo spreekt hij bijv. op blz. 92 over het molecule van natriumhydroxyde, en zegt dat ‘men moet aannemen, dat een cubieke decimeter natriumhydroxyde-gas 40 maal zooveel weegt als een halve cubieke decimeter waterstofgas’. Als de denkende leerling van zooeven bij deze woorden vraagt, waarom men dat moet aannemen, zou het den schrijver uiterst moeielijk zijn hem een bevredigend antwoord te geven. Intusschen is reeds vóór blz. 92 gebleken, dat de medegedeelde definities van moleculen en atomen slechts voorloopige definities waren. In het elfde Hoofdstuk wordt eerst besproken, hoe eenvoudig de voluumverhoudingen zijn, waarin de gassen zich chemisch verbinden. Dan volgt de wet der veelvoudige verhoudingen. Daarna geeft de schrijver eene beknopte schets van de atoomtheorie, om dan de juiste definitie van moleculen en atomen te laten volgen. Hierbij wordt de onderstelling van Avogadro gebruikt, maar zonder dat er met een enkel woord vermeld wordt, waarom die hypothese veel waarschijnlijker is dan eenige andere onderstelling, die men over hetzelfde onderwerp zou kunnen maken. Heeft de schrijver de argumenten voor de waarheid van Avogadro's hypothese verzwegen, omdat hij meende, dat zij voor de leerlingen te hoog zouden zijn? In dat geval zijn wij het volkomen met hem eens. Maar uit die overtuiging zouden wij afleiden, dat ook de hypothese zelve in een heuristisch leerboek hier nog niet vermeld had moeten worden. Na deze uitbreiding van de voorloopige beschouwingen over moleculen laat het zich verdedigen, dat de schrijver over moleculen van stoffen spreekt, die niet in damptoestand bekend zijn. Maar het blijft voor den leerling geheel onbegrijpelijk hoe men er toe komt het moleculairgewicht van die stoffen te bepalen. De schrijver heeft deze groote leemte nergens aangevuld, en ook | |
[pagina 258]
| |
voor zoover ik heb kunnen nagaan, den leerling nergens op haar bestaan gewezen. Als den grond, waarom het waarschijnlijk is, dat het molecule van natriumhydroxyde 40 weegt, vermeldt de schrijver, dat men voor de dichtheid van natriumhydroxydedamp het cijfer 20 moet aannemen. Maar hij weet toch wel, dat de zaak zich juist andersom toedraagt. Men houdt het voor waarschijnlijk, dat de dichtheid van natriumhydroxydedamp, als die damp bestaan kan en hare dichtheid mettertijd eens bepaald wordt, 20 zal blijken te zijn, omdat men langs een anderen weg gevonden heeft, dat het molecule 40 moet wegen. De zuiver scheikundige methode ter bepaling van de moleculairgewichten wordt door Dr. Enklaar met stilzwijgen voorbijgegaan. Later volgt nog eene zeer juiste, maar voor de leerlingen wel wat abstracte uiteenzetting van de leer der valentie, welke wij hier niet verder zullen bespreken. En daarmede eindigt het theoretisch gedeelte van zijn werk, het gedeelte, waarin de heuristische methode ons het bewijs moest leveren, dat zij opgewassen is tegen de eigenaardige bezwaren, die de theoretische chemie haar aanbiedt. Overtuigd, dat de methode van den schrijver de eenige is, die bij het middelbaar onderwijs in de scheikunde mag gebruikt worden, als men zich niet in de eerste plaats de verspreiding van scheikundige waarheden maar de ‘ontwikkeling’ der leerlingen ten doel stelt, heb ik met groote belangstelling zijne poging gevolgd om die methode in een bruikbaren vorm te brengen. Aan een helder inzicht in de bezwaren van zijne taak heeft het hem evenmin ontbroken als aan schranderheid in het wegnemen van die bezwaren. Toch kan ik blijkens het voorgaande niet meenen, dat hij in zijne behandeling van het onderwerp ten volle geslaagd is. Hier en daar moest de geheele waarheid verzwegen worden, om de leerlingen uit de halve waarheid (soms ook uit halve onwaarheid) te doen ‘vinden’, wat de waarheid lang zoo gemakkelijk niet vinden laat. Op andere plaatsen, bijv. bij de wet van Avogadro, moesten de leerlingen niet analytisch ‘vinden’, maar dogmatisch en synthetisch ‘gelooven’ of ‘aannemen’, wat de docent hun mededeelt. Dat ik die zwakke punten opzettelijk heb aangewezen, en over het voortreffelijke in het boek in algemeene bewoordingen ben heengegleden, ligt waarlijk niet aan den lust om op den schrijver te vitten, die eene moeielijke taak met veel ijver en schranderheid heeft ten einde gebracht, maar uitsluitend aan mijn wensch | |
[pagina 259]
| |
om te doen uitkomen, hoe moeielijk de heuristische of analytische methode bij het onderwijs in de scheikunde is. De bezwaren, die men te overwinnen heeft, als men de leerlingen op den weg wil brengen om zelf de begrippen en de stellingen der theoretische chemie uit de gegeven waarnemingen te vinden, worden door velen niet in hunne ware grootte gekend. Dr. Enklaar heeft ze helder ingezien, en daardoor onderscheidt zich zijn Leerboek, even als dat van Arendt en van Gunning, voordeelig van de meeste andere. Men meent aan de heuristische methode alle eer gegeven te hebben, die haar toekomt, wanneer men de eerste bladzijden van het leerboek met de beschrijving van eenige proeven vult, om dan dadelijk in al de abstracta te vervallen, die de synthetische methode vooropstelt Zoo worden bijv. in de Hollandsche vertaling van het leerboek van Roscoe, dat op de middelbare scholen het meest gebruikt wordt, reeds op blz. 13 de chemische formules ingevoerd met de volgende beschouwing: ‘Deze teekens (O, Cl, enz.) duiden echter niet alleen den naam van het element aan, maar tevens eene bepaalde hoeveelheid daarvan (zie de lijst der enkelvoudige stoffen). De getallen, die aldaar achter den naam van het element gedrukt staan, geven de gewichtsverhoudingen aan, waarin de elementen zich onderling verbinden en worden daarom verbindingsgewichten genoemd. Zij dragen ook wel den naam van aequivalentgetallen om uit te drukken, dat die hoeveelheden der elementen dezelfde waarde in verbinding hebben en elkander dus in die verhouding in verbinding kunnen vervangen. De laatste naam is echter minder juist, omdat niet alle elementen elkander in verbinding kunnen verplaatsen’Ga naar voetnoot1. Welke ‘bepaalde hoeveelheden’ de teekens voorstellen, is natuurlijk voor den leerling een ondoorgrondelijk raadsel, O is 16 gewichtsdeelen, maar hoe groot zijn die gewichtsdeelen? Leerlingen, die de goede gewoonten hebben den leeraar eene nadere verklaring te vragen, zoodra hij iets vertelt, wat zij niet begrijpen, kunnen niet nalaten die vraag te doen. Zegt men tot hen: ‘die gewichtsdeelen hebben eene willekeurige grootte’, zooals men op deze hoogte van het onderwijs nog zou kunnen doen, dan vragen zij, hoe eene gewichtshoeveelheid te gelijker tijd ‘bepaald’ en ‘willekeurig’ kan wezen. Op die vraag is wel | |
[pagina 260]
| |
een antwoord te geven, maar dat antwoord onderstelt de behandeling van vele zaken, die bij Roscoe eerst later volgen. Het juiste antwoord - ‘die gewichtsdeelen stellen het gewicht van een atoom waterstof voor’ - kan door de leerlingen volstrekt niet begrepen worden, zoolang er niet over atomen gesproken is, die in het boek veel later behandeld worden. De namen verbindingsgewichten en aequivalentgetallen, die hier op de atoomgewichten worden toegepast, zijn niet alleen minder juist om de reden, die de schrijver opgeeft, maar volkomen strijdig met de heerschende chemische beschouwingen. Deze fout is zonder twijfel alleen toe te schrijven aan den wensch om den leerling de atoomgewichten te laten gebruiken in eene periode van den cursus, waarin hij de beteekenis van het woord nog niet begrijpen kan. Dat de elementen zich ook in gewichtsverhoudingen kunnen verbinden, die door de veelvouden der (zoogenaamde) verbindingsgewichten worden uitgedrukt, wordt hier opzettelijk verzwegen. Dit geschiedt zeker met de goede bedoeling om het den leerling niet moeilijk te maken. Maar op de volgende bladzijde wordt de formule van kaliumchloraat gegeven, waaruit ieder lezer kan bemerken, dat de elementen zich ook nog wel in andere verhoudingen kunnen verbinden dan door de zoogenaamde verbindingsgewichten worden uitgedrukt. Wie nadenkt over wat hij leest, keert het blad om en overweegt, dat òf de formule van het kaliumchloraat verkeerd moet zijn opgegeven, òf de schrijver zich in de geciteerde woorden niet juist heeft uitgedrukt. Wie de tegenwerping maakt, dat de leerlingen op de middelbare school zoo nauw niet zien, zegt iets, dat wel in vele gevallen waar zal zijn, maar dat toch niet waar behoorde te zijn, en vergeet, dat het zeer verkeerd is, aan de slechte gewoonte van oppervlakkig denken voedsel te geven, door dingen te vermelden, wier tegenstrijdigheid in het oog moet vallen, zoodra men ze nauwkeurig beziet. De merkwaardige bijzonderheid, dat eene zelfde lijst de gewichten der elementen voorstelt, die of wier kleinste veelvouden zich verbinden met 16 gewichtsdeelen zuurstof of de kleinste veelvouden daarvan, met 32 zwavel of de kleinste veelvouden daarvan, met 35.5 chloor of de kleinste veelvouden daarvan, enz., ligt wel in de woorden van den schrijver opgesloten, maar de leerling moet een zeer opmerkzaam lezer zijn om er zijne aandacht op te vestigen. Om den leerlingen spoedig | |
[pagina 261]
| |
de vaardigheid in het behandelen van chemische formules te geven, die onmisbaar is als hunne feitenkennis eenigszins uitgebreid zal worden, glijdt de schrijver over al de belangrijke ontdekkingen en hypothesen heen, die de scheikundigen door hun teekenschrift uitdrukken. Doch hij zal dit verzuim later goedmaken. Naar aanleiding van de verbindingen van stikstof en zuurstof wordt de wet der veelvoudige verhoudingen besproken. Dan komt eene korte schets van Dalton's atoomtheorie. Daarbij wordt van den leerling niet alleen gevorderd, dat hij de onderstelling zal begrijpen, dat er voor de deelbaarheid der stoffen eene grens is, die bij scheikundige werkingen niet overschreden wordt, zonder dat de stof chemisch verandert, en dat de ‘kleinste deeltjes’, waarop die grens wijst, bij eene zelfde stof alle aan elkander gelijk zijn. Dit is onvermijdelijk noodig, schoon de schrijver het laatste niet opzettelijk vermeldt. Maar daarenboven verlangt hij, dat de leerlingen zullen aannemen, ten eerste, dat niet slechts de samengestelde stoffen, maar ook de elementen moleculen hebben, die men van de atomen onderscheiden moet, ten tweede, dat Avogadro zijne onderstelling te recht gemaakt heeft, ten derde, dat de moleculen van de meeste enkelvoudige stoffen uit twee atomen bestaanGa naar voetnoot1. Daardoor moet de leerling een denkbeeld verkrijgen van de wijze, waarop de scheikunde komt tot de moleculairgewichten en de atoomgewichten, die hij in 't vervolg voortdurend zal gebruiken. Maar die leerling ziet geen enkele reden, waarom men ook bij de elementen van moleculen zou moeten spreken; hij is volkomen ongeschikt om te beoordeelen of de onderstelling van Avogadro op eenigen redelijken grond steunt; hij kan volstrekt niet vermoeden, waarom men aanneemt dat de moleculen van de meeste elementen twee atomen bevatten. Van hem te vorderen, dat hij zich zal neerleggen bij de uitkomsten, die hij door de toepassing van dergelijke stellingen verkrijgen kan, is hem oefenen niet in het denken, maar in het gelooven op gezag. Als de leeraar, die zulk eene methode volgt, later, tegen het einde van den cursus, de gronden tracht aan te geven voor de beweringen, die hij in het begin heeft aangenomen, zooals ook Roscoe doet, dan spreekt hij voor zeer onwillige ooren. Zijne toehoorders hebben nu eenmaal geloovig en vertrouwend aangenomen, dat | |
[pagina 262]
| |
het atoom chloor 35.5 weegt, het molecule chloorkwik 271. Zij zijn daar even zeker van, als dat chloor groen is en sublimaat wit. En zij begrijpen den leeraar niet, die hun wil duidelijk maken, waarom zij er van overtuigd mogen zijn. Zij krijgen den indruk, dat hij zich veel onnoodige moeite geeft om te pleiten voor eene zaak, die toch onwankelbaar vast staat. Gelukt het hem eindelijk hun onwankelbaar geloof in de theoretische meeningen, die zij hebben aangenomen, te schokken, dan is het tien tegen een, dat zij tot volslagen scepticisme vervallen. De leeraar heeft hun eerst verzekerd, dat het moleculairgewicht van ammonia 17 is. Dit zouden zij gelooven, zelfs al stond het niet in hun boek, aan het hoofd van al de onbetwistbare feiten, die daarin over de ammonia worden medegedeeld. Een half jaar later blijkt hun echter, dat het moleculairgewicht van ammonia alle dan 17 moet zijn, als deze en die en die onderstelling te recht gemaakt is. Hoe meer de leeraar zich beijvert hen van de waarschijnlijkheid dier onderstellingen te overtuigen, des te meer trekt het hunne aandacht, dat hij sommige dingen, die hij vroeger als waarheden heeft medegedeeld, slechts met grooter of kleiner waarschijnlijkheid kan vermoeden. De weg, waarlangs zij in de scheikunde zijn binnengeleid, heeft hen niet kunnen doen bemerken, dat de hypothese in het arsenaal der natuurwetenschap het nuttigste wapen is. Tot dusverre meenden zij alleen volstrekte waarheden te kennen. Wel zouden zij bij nader overdenking moeten inzien, dat men de eigenschappen van atomen en moleculen niet met dezelfde zekerheid kan kennen als die van zichtbare dingen. Maar wie kan verwachten, dat schooljongens ernstig zullen nadenken over dingen, die hun weinig belang inboezemen, als men ze niet in de noodzakelijkheid brengt het te doen? Met het geloovig vertrouwen, dat den mensch in het algemeen en den schoolknaap in het bijzonder kenmerkt, als hij hoort spreken over dingen, die hij maar ten halve of in het geheel niet begrijpt, hebben zij de gansche chemische theorie voor eene volstrekte waarheid aangezien. Tracht men hen later aan het verstand te brengen, dat die theorie wel een zekeren graad van waarschijnlijkheid bezit, maar in geen enkel opzicht volkomen zeker, in sommige opzichten vrij onzeker is, dan loopt men groot gevaar hen de geheele wetenschappelijke scheikunde onder de willekeurige verzinsels te doen rangschikken. Want men heeft de gelegenheid verzuimd hen te doen inzien, dat | |
[pagina 263]
| |
verzinsels niet altijd willekeurig zijn, en dat een met beleid gekozen verzinsel, eene hypothese, eene uiterst belangrijke zaak zijn kan, al is zij nooit volkomen zeker, zoolang zij hypothese blijft. Waaraan kan het liggen, dat de leerboeken over de scheikunde bijna allen volgens de synthetische methode zijn ingericht, die, als zij bij het onderwijs gebruikt wordt, veel minder geschikt is om den leerling te leeren denken, en veel meer om hem in korten tijd met vele chemische feiten bekend te maken? Volgens mijn gevoelen ligt de oorzaak van dit verschijnsel vooral hierin, dat het volgen van de synthetische methode in een leerboek groote voordeelen heeft, die bij het mondeling onderwijs wegvallen. In zulk een leerboek vindt de leerling alle bijzonderheden, die op eene stof betrekking hebben, bij elkander, terwijl zij een analytisch leerboek heinde en verre verspreid zijn. Dit laatste is voor een boek, dat bij het classicaal onderwijs zal gebruikt worden, een overwegend bezwaar, waarin de onderwijzer moeilijk kan voorzien. Daarentegen kan hij aan de onvolkomenheden van een synthetisch leerboek door zijn onderwijs tegemoet komen. Desnoods kan hij zijn onderwijs zuiver analytisch inrichten, en de leerlingen hun synthetisch leerboek alleen laten gebruiken ter herhaling van het vroeger behandelde, waarvoor het altijd verreweg de voorkeur verdient. Daarom bevreemdt het mij niet, dat de synthetische leerboeken in het algemeen, en Roscoe's leerboek in het bijzonder, veel gebruikt worden. De beknoptheid en de duidelijkheid, waarmede de voornaamste feiten in dat boek vermeld worden, zijn eigenschappen, die het in de oogen van ieder docent eene hooge waarde moeten geven. Meent hij door zijn onderwijs de gapingen te kunnen aanvullen, die de uiteenzetting der chemische theorieën daarin vertoont, dan zal hij niet gemakkelijk een tweede leerboek vinden, dat zoo geschikt is om het overzicht over vele belangrijke chemische feiten voor de leerlingen gemakkelijk te maken. Een analytisch leerboek daarentegen maakt niet alleen het overzien der feiten voor de leerlingen veel moeilijker, maar heeft nog eene andere zwakke zijde. De schrijver heeft daarin de methode geschetst, volgens welke hij zijne leerlingen de gegevens der ervaring leert ‘analyseeren’. Maar de meeste onderwijzers, die, even als hij, hunne leerlingen willen laten ‘analyseeren’ en ‘vinden’, kunnen geen vrede hebben met den weg, waarlangs hij zijne leerlingen leidt. Synthetisch kan | |
[pagina 264]
| |
de wetenschap slechts op eene enkele wijze voorgesteld worden; men kan in kleine bijzonderheden van den gebaanden weg afwijken, maar het schema van een synthetisch leerboek is uit den aard der zaak in elke periode nauwkeurig aangewezen. Gebruikt men de analytische methode, dan kan men niet één, maar vele wegen volgen, en welken weg men bewandelen wil, hangt af van de individualiteit van den leeraar. Daarom zal een analytisch leerboek bij het classicaal onderwijs alleen gebruikt kunnen worden door den schrijver zelf en de weinigen, die niet slechts volgens de analytische methode willen onderwijzen, maar dat ook nagenoeg op dezelfde wijze willen doen als de schrijver. De anderen zullen liever bij hun analytisch onderwijs den leerling een synthetisch leerboek in handen willen geven dan een analytisch leerboek, waarin niet de weg gevolgd wordt, dien zij den besten achten. Want heeft hij het eerste, dan kan de leerling zijn boek gebruiken om zijne kennis van feiten op gemakkelijke wijze te onderhouden, terwijl hij in het tweede de feiten, die bij elkander behooren, niet dan met groot tijdverlies kan bijeenzoeken. En beide brengen den leeraar evenzeer in de minder wenschelijke noodzakelijkheid de volgorde der behandelde onderwerpen bij zijn onderwijs geheel anders te doen zijn dan in het boek, dat de leerlingen gebruiken. Men mag daarom bij leerboeken, als dat van Dr. Enklaar, slechts op een tamelijk beperkt aantal verbruikers rekenen. Volgens mijne meening zou dat aantal echter iets grooter kunnen zijn dan het thans worden zal, als de schrijver bij de bepaling der atoomgewichten en moleculairgewichten de hypothese van Avogadro niet vooropgesteld had. Hoe verdienstelijk die hypothese reeds bij haar ontstaan geweest zijn moge, hoe uiterst waarschijnlijk zij door de latere onderzoekingen geworden is, zij verdient mijns inziens de eereplaats niet, die men haar in de theoretische scheikunde geeft, en bij den aanvang van het middelbaar onderwijs in de scheikunde moet zij niet alleen de eereplaats aan andere dingen afstaan, maar moet zij liefst in 't geheel niet vermeld worden. Zij brengt ons toch alleen tot de kennis van het moleculairgewicht van gassen en van vluchtige stoffen, indien men namelijk wil aannemen, dat het onderscheid, door sommige scheikundigen tusschen physische en chemische moleculen gemaakt, op geen deugdelijke gronden berust. Zelfs wanneer men dit aanneemt, blijven de moleculen der | |
[pagina 265]
| |
stoffen, die niet vluchtig zijn, even onbekend, nadat de wet van Avogadro besproken is, als voor dien tijd. En die stoffen zijn zeer talrijk. Scheikundige beschouwingen zijn noodig om het gewicht harer moleculen te vinden. Het moleculairgewicht van chloorammonium en van vele andere verbindingen, o.a. van al degenen, waarin de elementen der stikstofgroep door vele scheikundigen als quinquevalent beschouwd worden, geeft nog andere bezwaren, die men slechts ontgaat door te veronderstellen - wat trouwens zeer waarschijnlijk is - dat zulke stoffen niet in den volkomen gastoestand bestaan kunnen. Maar dan zijn alweder scheikundige beschouwingen noodig om de gewichten van zulke moleculen te bepalen. Is het dan niet beter de moleculairgewichten en de atoomgewichten van alle lichamen alleen uit de zuiver scheikundige waarheden af te leiden, en eerst later te vermelden, dat die bepalingen eene onverwachte bevestiging verkregen hebben door de wetten van Avogadro en van Dulong en Petit? Zoo volgt men in de uiteenzetting van de hedendaagsche wetenschap den loop der geschiedenis. De wet van Avogadro heeft weinig invloed gehad op de vaststelling der moleculairgewichten en der atoomgewichten, die men thans aanneemt. Geheel andere beschouwingen hebben tot het vaststellen van die cijfers geleid. Bij het onderwijs een anderen weg te volgen dan waarlangs de scheikunde werkelijk gegaan is, zou alleen raadzaam zijn, als die andere weg aan de leerlingen veel onvruchtbare en onnoodige moeite bespaarde. Dit kan voor personen, die de natuurkunde kennen, werkelijk het geval zijn, als men de wet van Avogadro vooropstelt. Daarom hebben A.W. Hofmann en Lothar Meyer dien weg gekozen in de werkenGa naar voetnoot1, waardoor zij zoo veel hebben bijgedragen tot de verspreiding der nieuwere chemische theorieën. Trouwens ook voor zulke leerlingen blijft het bezwaar bestaan, dat de moleculairgewichten der niet-vluchtige stoffen door andere beschouwingen gevonden moeten worden, waardoor zij in dezelfde moeielijkheden vervallen, die men hun wilde besparen. De voordeelen van deze methode bestaan echter voor de leerlingen | |
[pagina 266]
| |
der middelbare scholen in het geheel niet. Tijdens den eersten cursus is de hypothese van Avogadro voor hen eene bewering, wier beteekenis zij moeielijk kunnen vatten, en men kan er niet aan denken hun de feiten en de redeneeringen mede te deelen, welke die hypothese zeer waarschijnlijk maken. De toepassing van de hypothese ter bepaling van de moleculairgewichten en atoomgewichten vordert van hen eene bekendheid met de eigenschappen van gassen en dampen, die men hoogstens tegen het midden van den tweeden cursus mag onderstellen. Veel gemakkelijker nog begrijpen zij de chemische gronden voor de vaststelling der moleculairgewichten en atoomgewichten. Het is niet zoo bijzonder moeielijk hun aan het verstand te brengen, dat de waterstof in het zoutzuur nooit anders dan in haar geheel, in het water voor de helft of in haar geheel, in de ammonia voor ⅓, ⅔ of in haar geheel gesubstitueerd wordt. Hebben zij dit begrepen, dan behoeven zij alleen de onderstelling te maken, dat de gelijksoortige deeltjes, waarin eene weegbare hoeveelheid van eene verbinding zich bij scheikundige werkingen splitst, alle aan elkander gelijk zijn, om het begrip van moleculen te vatten en tevens in te zien, hoe men tot de kennis van het aantal atomen in het molecule komt. Het geloof aan die onderstelling zou ik hun gaarne besparen, zooals ik hun gaarne alle autoriteitsgeloof besparen zou. Maar ik zie er geen kans op, en het is dan ook de eenige zaak, die zij gelooven moeten, terwijl zij daarenboven zelf moeten erkenen, dat er op hun standpunt even veel reden bestaat om te onderstellen, dat die deeltjes gelijk als dat zij ongelijk zijn. Is het begrip molecule eenmaal gevat, dan zijn zij het voor hen zoo onverkwikkelijk gebied der abstracta te boven gekomen. Hun verdere weg leidt hen vooreerst langs de lachende velden van het zinnelijk waarneembare. De weg, dien ik zou willen inslaan, wordt grootendeels gevolgd in het leerboek, waaraan Prof. J.W. Gunning - helaas, nu reeds sedert bijna vier jaren - werkt. Daarom bejammer ik het des te meer, dat zijne Beginselen der Algemeene Scheikunde blijkbaar niet met het oog op de middelbare school geschreven zijn. Stijl en schrijfwijze, het gebruik van woorden, die voor de leerlingen der middelbare school onverstaanbaar zijn, enkele voorbeelden van onvastheid in de toepassing van de nomenclatuur, dit alles wijst ten duidelijkste aan, dat de schrijver zich oudere en meer ontwikkelde lezers | |
[pagina 267]
| |
voorstelde dan de leerlingen op den derden cursus der hoogere burgerschool zijn. Daarenboven brengt hij in zijne ‘Gronden der Chemische leer’ zeer spoedig het verschil tusschen physische en chemische moleculen ter sprake, dat volgens zijne opvatting bestaan moet of althans bestaan kan. Zoo de wetenschappelijke strengheid dit onverbiddelijk vorderde, het strekt niet om het begrijpen voor den jeugdigen lezer gemakkelijk te maken. Eindelijk is het aantal feiten, die medegedeeld worden in het gedeelte van het werk, dat tot dusverre verschenen is, veel te groot voor de middelbare scholen. In het bijzonder maakt de uitvoerige behandeling der verbindingen van sommige zeldzame elementen het voor den leeraar, die het boek in de hoogere klassen gebruiken wil, noodzakelijk groote gedeelten daarvan over te slaan. En ook bij de andere gedeelten moet hij de leerlingen meer op zijn mondeling onderwijs doen steunen dan hij anders in de hoogere klassen wenschelijk zou vinden. Ten aanzien van het onderwijs in de scheikunde is er behalve de methode nog een tweede punt, dat de aandacht van ieder verdient, die, zonder hoofdzakelijk scheikundige te zijn, in het middelbaar onderwijs belang stelt. Het is de vraag of er op de hoogere burgerscholen met vijfjarigen cursus niet te veel tijd aan de scheikunde besteed wordt. Als men de leerboeken doorbladert, die bij dat onderwijs gebruikt worden, dan voelt men zich gedrongen die vraag bevestigend te beantwoorden. Het boek van Dr. Enklaar is in dezen minder geschikt om als maatstaf gebruikt te worden, omdat het alleen de anorganische chemie behandelt, en waarschijnlijk vooral met het oog op de scholen met driejarigen cursus geschreven is. Toch kan ook zijn tweede deel dienen om een bevestigend antwoord op die vraag uit te lokken. In dat tweede deel vinden wij bijna niets anders dan eene optelling van de bereidingswijze en de eigenschappen der belangrijkste zouten en zuren, met eene tamelijk uitvoerige beschrijving van de kenmerkende reacties der belangrijkste bases en zuren. Dit laatste heeft zeker met het oog op de practische oefeningen in het laboratorium zijne nuttige zijde. Maar ik zoek te vergeefs naar de eigenlijke bedoeling, waarmede Dr. Enklaar in zijn voorrede aangaande dat tweede deel schreef: ‘In de eerste zestien hoofdstukken van mijn boek vindt de leerling tal van voorbeelden, die hem met inductieve redenee- | |
[pagina 268]
| |
ring vertrouwd zullen maken, terwijl hij vooral aan de vele op zich zelf staande verschijnselen, die in het tweede deel beschreven zijn, zijne eigene kracht kan beproeven.’ Welke inductieve redeneering de leerling zal kunnen maken nadat hij de bereidingswijze en de eigenschappen van enkele zouten van het een of ander metaal heeft leeren kennen, is mij volkomen duister. Men kan toch niet meenen, dat hij de inductieve redeneering zou kunnen maken, waardoor de theoretische chemie tot de eigenschappen der atomen en der moleculen, bepaaldelijk tot de valentie der eerstenGa naar voetnoot1 en de constitutie der laatsten opklimt. Die inductieve redeneeringen zijn juist in de scheikunde der metalen in hooge mate onvolledig en zij vereischen de kennis van veel meer feiten, dan Dr. Enklaar mededeelt, en de leerling der burgerschool zou kunnen onthouden. Of is de bedoeling misschien alleen, dat de leerling zelf de karakteristieke reacties der groepen zal weten te vinden, als hij die van de leden der groep gezien heeft? In dat geval is de naam van inductieve redeneering voor die verstandelijke operatie al te deftig. Kent de leerling de reacties der afzonderlijke stoffen, dan bemerkt hij oogenblikkelijk welke bij alle dezelfde zijn; kent hij ze niet, dan is hij buiten staat ‘zijne eigene kracht te beproeven.’ Waarlijk, Dr. Enklaar heeft het beste deel gekozen, toen hij de heuristische methode in de zestien eerste hoofdstukken toelichtte, en het aan den leerling overliet zijne krachten te beproeven aan de ‘vele op zich zelf staande verschijnselen’ uit het tweede deel. Wordt er in de verschillende studiejaren te zamen acht uur aan het mondeling onderwijs in de scheikunde besteed, dan moet de docent er toe komen nu en dan ‘vele op zich zelf staande verschijnselen’ te beschrijven, bij welke de leerling niet veel anders kan doen dan getrouwelijk op te nemen, wat de leeraar voordraagt, en waarbij zijne eigene werkzaamheid bijna uitsluitend bestaat in het aanschouwen van de proeven en het onthouden van de feiten. Sommige van die op zich zelf staande verschijnselen hebben een groot practisch belang, hetzij wegens hun algemeen voorkomen in de natuur of omdat zij den grondslag uitmaken van gewichtige takken van nijverheid. Daarom | |
[pagina 269]
| |
kunnen zij bij het onderwijs in de scheikunde niet geheel gemist worden. Maar hun aantal moet zoo klein zijn, als het bij mogelijkheid gemaakt kan worden. Het onderwijs in de scheikunde verliest het grootste deel van zijne waarde, als het voornamelijk bestaan moet in het mededeelen van chemische waarheden, die den leerling niet kunnen leiden tot nieuwe chemische begrippen. Daarom moet de scheikunde der metalen op de middelbare school zoo beknopt mogelijk behandeld worden. Ook dan zal het den leeraar eenigszins moeilijk vallen te voorkomen, dat de ingenomenheid, waarmede de scheikunde in den eersten cursus ontvangen is, in den tweeden cursus bij sommige leerlingen voor afkeer plaats maakt. De organische chemie levert weder de gelegenheid om den leerling bekend te maken met verschillende chemische begrippen, die niet zoo duidelijk en niet zoo ongekunsteld uit de anorganische scheikunde kunnen afgeleid worden. Dat het begrip van constitutie wel degelijk in de feiten gegrond, en niet zooals men vroeger meende, eene vrij willekeurige voorstelling is, zal den leerling eerst blijken bij het bestudeeren van de verschillende omzettingsproducten, die eene zelfde organische verbinding onder verschillende omstandigheden kan geven. Meer dan iets anders is de scheikundige geschiedenis van het azijnzuur de geschikte gelegenheid hem te doen inzien, dat het begrip constitutie niet in de lucht hangt, maar door de combinatie der bekende feiten noodzakelijk ontstaan moet. Wel is het niet onmogelijk den leerling dat begrip uit de anorganische scheikunde te laten afleiden; maar zijne onvermijdelijkheid springt daar niet zoo in het oog. De ‘constitutie’ van eene anorganische verbinding kan voor den leerling, dien men niet met de beschrijving van al te veel reacties kan overladen, lichtelijk eene conventioneele schrijfwijze van de formule worden. In de organische scheikunde daarentegen voert de beschouwing der scheikundige werkingen, die men ook op de middelbare school bespreken moet, van zelve tot de oplossing van het molecule in zijne samenstellende deelen. De isomerie en hare verklaring, de gisting en hare practische toepassingen, de belangrijkste natuurproducten uit het plantenen dierenrijk zijn onderwerpen, die het wenschelijk maken de organische scheikunde iets uitvoeriger te behandelen dan de scheikunde der metalen. Maar ik geloof dat men de waarde overschat, die de scheikunde als opvoedingsmiddel kan hebben, | |
[pagina 270]
| |
wanneer men voor haar gedurende den geheelen cursus meer dan 5 of 6 uren mondeling onderwijs en 2 of 4 uur practische oefeningen eischt. Dit is te weinig, wanneer men verlangt dat de leerlingen de grootste helft der feiten zullen kennen, die in het meest gebruikelijke leerboek, dat van Roscoe, vermeld zijn. Vooral in de organische chemie zouden zij aan dien eisch op verre na niet kunnen voldoen. Hoe beknopt echter dat boek ook zijn moge, de massa feiten, die het bevat, is voor den niet-scheikundige een te groote ballast, om hem in zijn volgend leven mede te dragen. Het mondelinge onderwijs in de scheikunde heeft alles gedaan, wat het doen kan, als het den leerling, vooreerst, beter heeft leeren opmerken en waarnemen, ten tweede, zijne aandacht gevestigd heeft op de scheikundige verschijnselen in de natuur en in de nijverheid, en hem het begrijpen van die verschijnselen mogelijk gemaakt heeft, en als het, ten derde, den leerling een inzicht gegeven heeft in de wijze, waarop de scheikunde uit de gegevens der ervaring hare abstracte theorie opbouwt. De feitenkennis, die het daarenboven mededeelt, moge niet nutteloos zijn, zij kan niet in vergelijking komen met het voordeel, dat de leerling zou kunnen trekken uit het onderwijs in sommige vakken, die in de hoogere klassen van de middelbare scholen wat al te stiefmoederlijk bedeeld zijn.
C.B. Spruijt. |
|

