|
| |
| |
| |
III Hoe proteïnen spelen met ons
Dr. Ratnoff, de ontdekker van de Hageman-factor, isoleerde het goedje uit de 1270 cc plasma die hij oorspronkelijk verzameld had. Hij had het ene niet-actieve bestanddeel na het andere verwijderd, tot er maar twee milligram actief materiaal overbleef. Teruggebracht in oplossing, bleek de activiteit hiervan vergelijkbaar met niet meer dan 165 cc plasma. Daaruit blijkt dat er maar 165:1270 of ongeveer een achtste van de originele factoractiviteit over was gebleven door al die zuivering. Je kan nog meer berekenen. Je weegt bijvoorbeeld 50 kg; omdat je 45 cc plasma per kg bevat, kan je dus (45:165) ×50×2=zowat 25 mg Hageman-factor bevatten, hoogstens. Ongeveer 7% van je plasma is ciwitten, ofwel een totaal van 175 000 mg. Alles wat je aan Hageman-factor hebt is dan maar één zevenduizendste van de totale hoeveelheid eiwit in je plasma. Er is geen reden om aan te nemen dat de Hageman-factor het zeldzaamste proteïne van je lichaam is, ook al zijn sommige eiwitten verantwoordelijk voor een kolossaal deel; je bevat bijvoorbeeld 7000 mg fibrinogeen. Van duizenden andere ciwitten kan je ook best minder dan 25 mg hebben in je plasma en die kunnen dan nog voor ieder van ons een beetje verschillen ook. Ik kan mijzelf zien dwalen binnen mijzelf, een ondoordringbaar oerwoud van grillige vormen, en daarbinnen ik een blinde jager op ergens een zingende, of erger, een zwijgende vogel. Als hij zingt, en ik schiet, en hij krijst, of zwijgt, heb ik hem dan geraakt? Er valt nooit iets hoorbaar. En als ik een vreselijk gekras in een kooi weet te proppen, hoe kom ik er dan achter of ik niet eigenlijk per ongeluk een spuugratje heb gevangen dat mijn doodgeschoten vogel allang had opgegeten?
| |
Complicaties in het protrombinecomplex
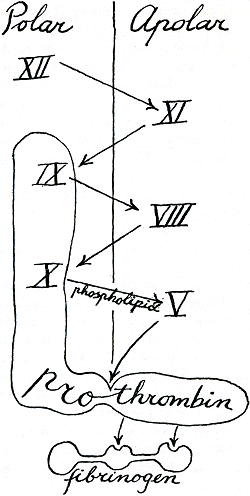
Heel wat mensen denken dat protrombine ons in een soort ootje neemt, en hier en daar verschillende maskers draagt die andere mensen factoren noemen. De factoren mensen daarentegen geloven dat de bloedstolling een serie, een cascade van reacties is, waarin elke stap neerkomt op de activering van een volgende factor. De cascade begint
| |
| |
als factor xii (Hageman-factor) door een oppervlak wordt geactiveerd zeggen zij; dan wordt hij een actief enzym, waarvan het substraat de nog onactieve factor xi is. Wat doet dan het enzym xii met dit substraat? Het maakt er een actief enzym van: actieve factor xi. Dan maakt xi factor ix actief, en dan maakt dat viii actief, en dat x

Figuur 24.
en dat v, en dat zet protrombine dan om in trombine, zeggen ze. Zie figuur 24. Zij die geloven in een maskerade (met dr. Walter H. Seegers als hun leider), verdenken protrombine ervan dat het de factoren ix en x zelf bevat. Alle drie: ix, x en protrombine ‘zelf’, worden in je lever gevormd. (Ook nog een vierde, factor vii, maar die heeft smurrie buiten je bloed nodig om in de stolling te werken, en al is ook hij misschien een deel van protrombine, vergeet hem toch maar voor het gemak.) Als je toevallig iemand bent die tabletjes moet innemen om trombose te voorkomen en je bloed moet daarom elke week worden onderzocht, dan ben je waarschijnlijk bezig een medicijn te nemen die de vorming van die vier factoren in je lever vertraagt. De andere stollingsfactoren worden daardoor niet beïnvloed; maar deze vier, die we het protrombinecomplex zullen noemen, doen allerlei dingen samen. Ze kunnen bijvoorbeeld alle vier geadsorbeerd worden op allerlei anorganische poeders, zoals aluminiumhydroxyde, calciumfosfaat, en bariumsulfaat. Wat hebben al deze poeders eigenlijk met elkaar gemeen?
| |
| |
Een onnozele vraag; ik had een onnozele stemming nodig om daarop, op een onnozele middag in het Mount Sinai-lab zittend, een onnozel antwoord te bedenken: elk van die poeders, in water gesmeten, wordt nat en zinkt. Nat! dat was wat, dacht ik opeens, daardoor meteen aan het denken gebracht: ze worden nat, ze zijn allemaal benatbaar, het protrombinecomplex wordt geadsobeerd op hydrofiele oppervlakken. Waardoor worden dus misschien wel de andere factoren geadsorbeerd?? Ik herinner me nog precies wat ik dacht en deed: waar vind ik een hydrofoob poeder? Moet erg onoplosbaar zijn. Bariumstearaat natuurlijk, waar oppervlaktemensen altijd laagjes op water van maken, dat wist ik toevallig. En dr. Sobotka, een echte oppervlakte- en stearaat-chemicus, die werkte op de tweede verdieping! Zover gekomen sprong mijn hele lichaam duidelijk op en was al op weg, deur uit, trap af, naar 's mans altijd geamuseerde assistente, ja hoor, ergens in die gangkast moest wel wat staan, in geen jaren gebruikt. En daar stond het. Ik het aan mijn benige, witbejaste borst klemmen en terug naar boven flapperen. Daar, in mijn lab, stortte ik onmiddellijk ongeveer tweehonderd milligram van het poeder in twee cc normaal plasma-van-de-dag. Zoals ik wel had kunnen verwachten, bleef het donzige witte poeder drijven. Heel wat ervan schoot zelfs langs de natte glaswanden van het buisje naar boven alsof het als de dood was nat te worden. Gelukkig, toen ik nog jong was, ongeveer 42 pagina's geleden, had ik al gemerkt dat proteïnen (of tenminste iets in het plasma) door adsorptie een hydrofoob oppervlak hydrofiel maken. Ik nam dus een dikke glazen staaf en porde het goedje omlaag. Eerst ging dat kwaad in klontertjes zitten, maar toen ik die voorzichtig, onder het plasma, tegen de wand van de buis fijnwreef, scheen het poeder opeens de strijd op te geven en liet zich erg lief in suspensie brengen. Zo mocht het ongeveer twintig minuten staan. Toen stak ik het buisje melkerigheid in de centrifuge.
Terwijl de machine suizend brulde werd het buiten donker. De technicians, en toen de secretaresses, en toen de doktoren, gingen naar huis. Ik verzamelde het heldere gedeelte van het behandelde plasma en begon er proeven op te doen. Eerst kijken hoe het met het protrombine stond: het corrigeerde de stolling van plasma dat met bariumsulfaat was behandeld; het protrombinecomplex was door het bariumstearaat dus niet weggenomen. Toen nam ik een beetje oud plasma uit de diepvries, plasma dat oorspronkelijk normaal was geweest maar dat
| |
| |
enige weken op een tafel had zitten rotten, eerlijk gezegd. Dat is namelijk een manier om factor v te vermoorden; die is zelfs zo ontdekt en heette dan ook vroeger Labile Factor. Dat oude plasma had natuurlijk ook een lange stollingstijd; en als mijn met bariumstearaat behandeld plasma geen factor v meer mocht hebben, dan mocht het dat oude plasma dus niet corrigeren. Gelukkig was dit allemaal geen traag werk: alle stollingstijden moesten gemeten worden met weefselextract (tromboplastine) erbij, en de normale tijden zijn dan twaalf tot twintig seconden voor dergelijke experimenten. Zie me dus daar zitten, achter een waterbad, met stopwatch en pipetten, een tiende cc dit plasma, een tiende cc dat plasma, een tiende cc tromboplastine, meng, een tiende cc calciumchloride en stopwatch aan, meng, kantel buisje een beetje, kijk, kantel, kijk, kantel, nog niets, al twintig seconden, kantel, kijk, nog niets, dertig seconden, nog niets; pas na vijftig seconden stolde het mengsel. Een brede grijns onderbrak mijn eerst zo ascetisch vogelkoppie overdwars. Het was waar! Ik had goed geraden! Bariumstearaat, een hydrofoob poeder, had factor v uit het plasma verwijderd. Veel later bleek mij dat factor xi, en een groot deel van factor viii en fibrinogeen, ook waren verdwenen. Nog later kon ik hetzelfde met andere hydrofobe poeders doen, en merkte bovendien dat ze liever trombine adsorbeerden dan protrombine. Nou weet je nog wel hoe het normaal in elkaar gerolde eiwitmolecule zijn hydrofobe aminozuren binnenin moet houden als het in water zweeft, en je kan je dus voorstellen hoe, tegen een oppervlak zoals bariumstearaat, het molecuul zich openrolt en met zijn vettige hart aan het vette poederoppervlak vastplakt. Als we nu het soort moleculen dat zich het makkelijkst zo opent en dus het liefst aan hydrofobe oppervlakken wil zitten omdat het zelf makkelijk hydrofoob kan doen,
‘apolair’ noemen, dan kunnen we de cascade van figuur 24 als een zigzag tekenen (figuur 25).
Op die manier kan je meteen alle factoren van het protrombinecomplex, die dus het ‘polairst’ moeten zijn (liever aan benatbare dan aan onbenatbare oppervlakken zittend), met elkaar verbinden tot een echt eiwitachtig kluwentje, waarvan het meest hydrofobe centrum de trombine is. Want als protrombine in trombine wordt veranderd, wordt het kleiner. Eerlijk gezegd is met zo'n diagram niets te bewijzen; ik hoop alleen maar dat het de cascade en maskerade met elkaar kan verenigen, want daar heb ik allebei vrienden in. Tot nu
| |
| |
toe vechten die namelijk nog met elkaar op elke stollingsbijeenkomst, en altijd met dezelfde gedachten:
C(ascade): ‘Kom maar eens bij ons kijken, dan zullen we je patiënten laten zien die elk maar één enkele factor missen, vii, of ix, of x, of protrombine, en verder niets; hoe verklaar je dat dan?’
Figuur 25.
M(askerade): ‘Zoals ik dat al jaren doe: die patiënten hebben alleen maar ieder een andere abnormale vorm van protrombine, ieder met zijn eigen onvermogen om je zogenaamde actieve factor af te splitsen.’
| |
| |
C: ‘Maar we kunnen elk van die patiënten met een ander, gezuiverd eiwit corrigeren!’
M: ‘Dat denk je maar. Al die gezuiverde eiwitten van jou komen van één plasmafractie en de enige actieve stof daarin was protrombine; ik kan al jouw patiënten corrigeren met dat ene bestanddeel en met de stoffen die daaruit in normaal plasma of serum ontstaan.’
C: ‘En wat doe je dan met onze patiënt die helemaal geen protrombine heeft en wel een normale hoeveelheid vii, ix en x? Die man kan blijkbaar onze cascade op normale manier laten stromen tot hij aan de stap komt waar het protrombine had moeten zijn; daar houdt hij op.’
M: ‘Die patiënt heeft een vorm van protrombine die normaal is behalve in het gedeelte dat in trombine moet worden omgezet. En omdat jullie, zowel als wij, alleen protrombine kunnen meten in de vorm van het trombine dat eruit gemaakt kan worden, nemen jullie uit je metingen aan dat er geen protrombine in het bloed van die patiënt was.’
C: ‘Maar je baseert deze verklaring, en al je andere, op het geloof dat jouw protrombine zuiver is. En uit het beetje protrombine dat we een keer van je gekregen hebben, konden wij, zoals je weet, stoffen afsplitsen die de specifieke werking hebben van factoren vii, ix en x.’
M: ‘Dat verbaast ons niets. Natuurlijk kunnen jullie die afsplitsen. Je springt zo ruw om met de protrombine die je van mij cadeau hebt gekregen, dat je het gedurende je hardhandige chromatografie aan stukken wringt, precies op de plekken waar het onder normale omstandigheden gedurende de stolling in stukken breekt; het zijn de stukken die de activiteit van vii enzovoort hebben. Waar zijn die factoren van jou voordat de stolling begint? Dan bestaan ze nog niet en geen van jullie kan me vertellen dat die dan wel bestaan.’
C: ‘Natuurlijk zijn ze er voor de stolling ook, maar als voorlopers, in nog onwerkzame vorm. Net als jouw zogenaamd zuivere protrombine een soort voorloper is; daar berust immers de hele cascade op, dat een factor de volgende activeert.’
M: ‘Ah, daar ben je eindelijk doorgedrongen tot de kern van je eigen waanzin. Wat voor soort redenering is dat: omdat je iets niet vinden kan, neem je aan dat het in een andere vorm bestaat? Mijn zogenaamd zuivere protrombine daarentegen, waarvan ik de eindstandige aminozuren herhaaldelijk bepaald en gepubliceerd heb, deze
| |
| |
groep aan dit einde, die aan dat einde-en welke andere stollingsfactor behalve fibrinogeen is tot dusverre ooit zuiver genoeg geproduceerd om dat te bepalen?-krijgt na jouw zogenaamde zuivering andere eindstandige aminozuren. Met andere woorden, je hebt mijn moleculen stuk gemaakt.’
C: ‘Is het niet minstens even waanzinnig om vier verschillende soorten abnormaal protrombine uit te vinden, als om aan te nemen dat onze patiënten een van de vier eiwitten missen?’
M: ‘Helemaal niet. Kijk maar eens naar al die verschillende abnormale hemoglobinen: allemaal met afwijkingen op verschillende plekken in een enkel molecuul, en daardoor met verschillende symptomen. Wat wel waanzin is, is die cascade van jou. Waar in de natuur vind je zo iets?’
C: ‘Overal. Kijk maar eens naar de serie enzymen die in de ademhaling werken, en een soort waterstofatoom doorgeven van het ene enzym naar het volgende.’
M: ‘Ja, maar dat zijn en blijven enzymen. In jouw idiote overstroming van factoren heb je een enzym dat van een onschuldig substraat een enzym maakt, en dan maakt dat enzym van zijn eigen substraat een enzym, en ik weet wel waarom je dat zo wil hebben: om de amplificatie, de geweldige versnelling, van het proces van de stolling te verklaren; niet waar?’
C: ‘Precies, onder andere.’
M: ‘Nou, die kan je net zo goed verklaren met wat we “positive feedback” noemen: het trombine dat gevormd wordt kan zelf uit protrombine meer trombine maken, dus het proces gaat vanzelf sneller en sneller; daarvoor hoef je toch niet een volkomen unieke cascade aan te nemen ?’
C: ‘Stolling is nu eenmaal volkomen uniek.’
Als al die knappe biochemici al zo worstelen met elkaar om te bewijzen dat hun eigen produkt het zuiverst en tegelijk het ongebrokenst is, wat blijft er voor ons dommeren dan te verdedigen behalve verdraagzaamheid? Want totdat iemand, of iets, in staat zal zijn zuivere protïnen te maken en tegelijk te bewijzen dat die precies zo zijn als die in ons levende lichaam, zullen de eiwitten met ons in het lab even hard terugspelen als wij met hen.
Hier is nog een voorbeeld. Veel menselijke organismen, ik ook, hebben geprobeerd het stollingssysteem van andere dieren te begrij-
| |
| |
pen. Hoe zou jij daaraan beginnen? Als ik je eens een hoop buisjes met gecitreerd, en gestold, en op andere manieren verzameld bloed gaf van een soort eend, bijvoorbeeld een Peking duck, en ik vroeg je dan of er de Hageman-factor, en de factoren v en viii in zaten? En als ik je dan ook nog een behoorlijke hoeveelheid menselijk plasma gaf, van normalen en van mensen zonder Hageman-factor of v of viii enzovoort; wat zou je dan doen? Hier heb je weer, gratis vrijgehouden, een paar regels wit om in na te denken.
Ik hoop dat je een elegante dubbele serie proeven hebt opgezet: een rij buisjes elk met wat menselijk plasma waaraan een factor ontbreekt; nog een rij, precies zo; beetje zoutoplossing, als controle, bij elk buisje van een rij; beetje eendeplasma bij elk buisje van de tweede rij; calciumchloride bij elk buisje en dan maar stollingstijden bepalen. In dat geval heb je werkelijk ontdekt dat de stollingstijd van de patiënt met gebrek aan de ene factor beter door eendeplasma wordt gecorrigeerd dan die van een patiënt met gebrek aan een andere factor. Velen van ons hebben echt dergelijke proeven gedaan. Bijvoorbeeld met plasma van meneer Hageman; en je raait nooit wat Peking duck-plasma daarmee deed: het maakte de stollingstijd van het gebrekkige mensenplasma langer! Net zo gek was het, dat de stolling van normaal mensenplasma in een glazen buisje niet door dit eendeplasma werd vertraagd, maar de stolling van ‘intact’ (ongeactiveerd) normaal mensenplasma in een plastic buisje wel. Ik las dat allemaal toen ik in Mount Sinai Hospital werkte, waar van alles kon, en ik kon dus dadelijk een paar eenden.
Nooit had ik gedacht dat de snoezen zo groot, zo wit en zo ernstig zouden zijn. Wel had ik gehoord dat de beste en plezierigste plek om bloed van een vogel te nemen, een okselvene was. Een flinke man, het beest en ik worstelden totdat het woeste hete kussen onder lag, op zijn rug op de operatietafel. Dan kromde het altijd zijn nek, het eigenaardig doch levend hoofd daarmee zo dicht mogelijk bij het mijne brengend en mij diep in of tussen de ogen blikkend. Ik glimlachte dan als het ware vertrouwelijk. De eend fronste. Met een watje alcohol stortte ik mij dan haastig in de verwarrend intieme hitte van zijn okseldons; maar als ik daar dan het juiste plekje had natgemaakt kwam onder de samengeplakte ijle vacht opeens de roze huid te voor-
| |
| |
schijn met een prachtig bloedvat eronder; en dan kon ik er een keurige hoeveelheid bloed uitnemen, terwijl de eend mij zachtjes met zijn gele pantoffels maat veertig tegen mijn borst trappelde. Daarna liep ik snel weg, maar zag omkijkend mijn helper nog rondwankelen, bevleugeld en beveerd, en tegen de witte muren de schaduw van een vreselijk levend vliegtuig werpend.

Figuur 26.
Het plasma van de pekingeenden bleek de stollingstijden te verkorten van mensenplasma waaraan factor v of viii ontbrak, en de stollingstijden te verlengen als er factor vii, ix, x of xii aan ontbrak. De juiste vraag is daarop: wat betekent dat allemaal? Een tijd later kreeg ik twee muskuseenden-witzwarte met ogen als verfrommelde rozen. In de gevallen waar het plasma van de pekingeenden het mensenplasma duidelijk remde, deed het muskuseendeplasma helemaal niets. Nog later nam ik wat bloed van een wilde eend met een groene kop en een gespalkt been: weer andere resultaten. Wat betekent dat, als het bloed van een diersoort iets anders doet met het bloed van een andere diersoort dan een andere diersoort? Neem de vijfde regel uit een wulps gedicht en zet die op de vijfde regel in een ander wulps ge-
| |
| |
dicht: geen van twee wordt daar beter van. Wat betekent dat? Een wereldschokkende ontdekking: de twee gedichten blijken waarachtig van elkaar te verschillen; meer niet. Net zo schokkend als het geknoei met die eenden; waaruit alleen maar blijkt dat een soort eend geen echte Hageman-factor heeft. Nou, hoogst waarschijnlijk heeft mijnheer Hageman ook geen eendefactor, maar ze maken het allebei uitstekend.
Wel hebben meneer Hageman en die vogels één eigenschap gemeen: hun plasma stolt niet veel vlugger in glas dan in plastic. Dat op zichzelf is nauwelijks genoeg voor mensen zonder Hageman-factor om niet met een pekingeend te trouwen, want welke eigenschappen van zo'n paar al dan niet verenigbaar zijn, daarnaar kan zelfs een eendkundige niet raden. Van elke soort afzonderlijk kunnen we alleen maar zeker zeggen: die bestaat nog, en heeft zich aan al zijn gebreken dus behoorlijk genoeg aangepast om nog een tijdje door te scharrelen. Een onbiologische dokter vroeg mij eens: ‘hoe is het protrombinepeil bij een eend?’ ‘Wat bedoel je met hoe?’ ‘Nou, hoe, hoog, laag of wat?’ ‘Bij een eend is het normaal, voor eenden, geloof ik. Hoe dacht je dat te bepalen ?’ ‘Je zou het toch gewoon met dat van een normaal mens kunnen vergelijken, kijken of het meer of minder is?’ Maar dat kan juist niet: het mensenprotrombine wordt gemeten in eenheden (je kan het immers niet zo maar uit het plasma halen en wegen!), en de eenheid is die hoeveelheid mensenprotrombine die, omgezet in mensentrombine, een kubieke centimeter mensenbloed in vijftien seconden laat stollen. Dus eendebloed kan je evengoed in menseneenheden uitdrukken als eendegekwaak in menselijke spreekwoorden. Je zou eerst moeten nagaan of de voorloper van trombine bij de bepaalde eendesoort lijkt op protrombine. Dan moet je een paar honderd eenden verzamelen die niet klagen over neusbloedingen of bloed in de ontlasting, en nagaan hoe groot de variatie is in, ja, wat het dan ook is dat je je verbeeldt te meten bij al die hopelijk normale dieren. Dan pas kan je gaan zoeken naar eenden die bijvoorbeeld beweren dat ze abnormaal lang bloeden na een kies te hebben laten trekken, zien of hun factoren en die van hun broers of ooms ook abnormaal zijn... kortom je moet waarschijnlijk evenveel tijd aan die soort eenden wijden als aan mensen met dergelijke
gebreken gewijd is. Dan pas kan je bijvoorbeeld een van de eendeëiwitten de naam Christmas Factor geven, naar een eend die Christmas heet en die dat
| |
| |
bepaalde eiwit mist.
Dat betekent allemaal alleen maar dat elk eiwitmolecuul in een eend een eendeëiwit is, behalve dan misschien het stukje mensenvinger dat hij in zijn maag zou kunnen hebben. Een eendeëiwit zou het nergens in ons lichaam leuk hebben, waar alle menseneiwitten elkaar schijnen te kennen; want terwijl het mengen van kleinere verschillen, zoals verschillende rassen, van voordeel is (zoals je verderop kunt lezen en in mijn gezin zien), is het mengen van grote soortverschillen onmogelijk. Ook kan je straks lezen over de kleine maar plotselinge veranderingen, mutaties, waar elk proteïne zo ongeveer eens in de tien miljoen jaar het slachtoffer van moet zijn, zoals de vervanging van een hydrofiel of hydrofoob aminozuurgroepje door een ander. Al dergelijke kleine mutaties zijn als de veranderingen in een sprookje zoals het door de eeuwen wordt oververteld; hier en daar wordt een verouderd woord door een nieuw vervangen en langzaam verandert het verhaal van gedaante maar niet van ziel. Soms ook wordt een woord, van ouderdom al onzin geworden, voortgeplant uit de middeleeuwen (Hageman-factor misschien, zoals ik al zei); maar al die veranderingen door de eeuwigheid van ons verleden hebben onze structuur niet vager gemaakt. Zelfs al kan het bloed van één diersoort soms een abnormaal tekort in het bloed van een andere diersoort ‘corrigeren’, dan mogen we ons toch nooit laten verleiden te denken dat het ene dier dus de factor heeft die in het andere dier ontbreekt. Hier is een typisch voorbeeld. Ik vertelde je daarnet dat de stolling van mensenplasma waaraan factor v ontbreekt gecorrigeerd wordt door pekingeend-plasma. Zoals je zou verwachten. wordt het ook gecorrigeerd door koeieplasma. Ik vertelde je ook al dat menselijke factor v oorspronkelijk Labile Factor heette, omdat die heel labiel is. Hij verdwijnt dan ook helemaal gedurende de stolling. Maar koeiefactor v doet dat helemaal niet en is
heel stabiel. De twee factoren v moeten dus volkomen verschillend zijn. Nog een voorbeeld uit de stolling: de hersenextracten, die zo dikwijls in stollingsproeven gebruikt worden, schijnen zich hun herkomst nog best te herinneren, want ze werken het hardst met plasma van hun eigen diersoort.
Toch beschrijft bijna iedereen in dit gebied proeven waarin hij bijvoorbeeld konijnehersenpoeder mengt met mensenplasma en koeieserum. De derderangs-junglefilm die zich in zo'n geklutst klein dierentuintje moet afspelen negeren wij meestal omdat we er geen
| |
| |
klauw van kunnen zien. We zien alleen maar één, gemiddeld resultaat, één getal op ons horloge, één stollingstijd, altijd misleidend.
| |
Eiwit en erfelijkheid
De spelletjes die eiwitten in onze reageerbuisjes met ons spelen zijn nog tot daar aan toe; die in onze lichamen zijn beslist misplaatst, tenminste als ze erfelijke ziekte betekenen. Want zoals je weet kan je bepaalde ziektes erven zoals je ook de kleur van je haar erft. Ergens in je lijf loert blijkbaar een onthoudmachine, dag en nacht rondglurend om te voorkomen dat een paar geestige hoofdhuidcellen zo nu en dan eens een bos haar van een nieuwe kleur produceren. Die hele erfelijkheidsmachine, de chromosomen, de genen-ik ben bang dat jij daar al meer van afweet dan ik; in ieder geval bestaan er betere boeken over dan dit, dus hier volgt maar een korte schets.
Als iets levends groeit, delen zich zijn cellen. Als een cel zich gaat delen, deelt zich eerst de kern. Als de kern zich gaat delen, delen zich eerst zijn chromosomen. Een chromosoom is een snoer van genen. Als een chromosoom zich deelt, moet dus elk gen in de snoer zich in twee helften splitsen, en iedere helft moet dan op een of andere manier weer uitgroeien tot een kopie van het oorspronkelijke hele gen. Een gen is voornamelijk een molecuul dat er als een uitgewrongen ladder moet uitzien en dna genoemd wordt (voor (deoxyribonucleic acid). Iedere sport van die ladder bestaat uit een enkel paar stoffen die elkaar met waterstofbanden vasthouden. Er bestaan maar twee soorten sport: adenine gecombineerd met thymine(a+t), en guanine gecombineerd met cytosine (g+c). Hier is een voorbeeld van zo'n ladder:
______________________
...c a t a t t g c g g g g...
...g t a t a a c g c c c c...
______________________
Als zijn tijd gekomen is, splijt de ladder waar hij het zwakst is: in de lengte, langs zijn middellijn van waterstofbanden, zodat we nu zitten met twee halve ladders, of, om het diagrammetje van daarnet maar te gebruiken, één stok waaraan de halve sporten c, a, t, a, t, t, enzovoort hangen, en een waaraan g, t, a, t, a, a, enzovoort hangen. Uit hun omgeving krijgt dan iedere halve sport weer een nieuwe kameraad:
| |
| |
de cees vinden gees, de aas vinden tees, en daar heb je dan warempel twee precies aan elkaar gelijke ladders waar er eerst maar een van was. De ‘boodschap’ die ligt opgesloten in de volgorde van de sporten, wordt gelezen door een ingewikkeld systeem van ribonucleïnezuren (rna-moleculen) en luidt meestal dat er een bepaald eiwit moet worden gevormd. Een bepaald eiwit: elk aminozuurschakeltje daarin wordt bepaald (gespeld kan je wel zeggen) door een serie van drie sporten in de dna-ladder. Laten we dus voor de grap eens hoofdletters geven aan verschillende aminozuurgroepen, en aannemen dat de code voor sommige is: D=ggg, T=cat, H=tat, A=att en N=gcg, dan zou de bovenste helft van de daarnet getekende ladder het bouwen van een stuk eiwit dicteren dat tand spelt. Maar o wee als de eerste letter, links bovenaan in die ladder, per ongeluk een t zou worden. Dan zou de boodschap verbasterd uit de kern blijven klinken want de drie linkse sporten zouden dan tat in plaats van cat spellen en dat zou H in plaats van T betekenen. Vanaf dat ogenblik zou het arme cellichaam (het cytoplasma) hand moeten maken in plaats van tand. Een heel verschil, vooral als je zo'n mutatie niet als een enkele zetfout kan negeren, maar als een fout die blijft terugkeren in het hele boek. Misschien zal een lang, zeldzaam woord in een uitgebreide tekst niet vaak onzinnig worden door een enkele mutatie en het relaas rondom hem niet belachelijk maken; maar hoe groter de rol van het woord in de zin is, en hoe gevoeliger de plek waar het door de mutatie wordt getroffen (hoe belangrijker het enzym en hoe meer het in zijn actieve plek van aminozuur is veranderd), des te erger natuurlijk. Verander in de zin: ‘na hun kopjes te hebben geledigd, wandelde het vorstelijk paar tevreden neuriënd weg’, maar
eens hier of daar een letter d door k. Er is maar één plaats waar dat een ramp veroorzaakt.
Het hoeft dan ook niet de hoeveelheid te zijn van het verkeerde of verminkte eiwit, die de schade veroorzaakt. Je kan een heel boek drukken waarin een van de meest voorkomende woorden verkeerd gespeld is, zoals ‘s’ in plaats van ‘is’. Dat s welswaar storend, maar de tekst s toch nog best te lezen en te begrijpen. Zo zijn er mensen wier bloed helemaal geen albumine bevat, en dat betekent dat het grootste deel van hun bloedeiwit afwezig is. Albumine is een nogal klein eiwit dat verantwoordelijk is voor een groot deel van de osmotische druk in je bloed, en voor het binden van bepaalde moleculen zoals
| |
| |
vetzuren die anders je rode cellen stuk kunnen maken; je moet dus verbaasd staan als ik je vertel dat mensen die deze enorme fout bevatten daar maar heel weinig van merken.
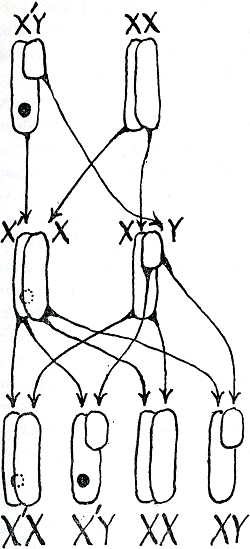
Daar staat helaas tegenover dat we een heel tragische vergissing begaan als we iets speciaals met een plek van een bepaald dna-molecuul in een bepaald chromosoom, dat we x noemen, fout doen. Je weet vrees ik al dat mannelijke en vrouwelijke geslachtscellen elk maar één stel chromosomen hebben (in tegenstelling tot de rest van je lichaamscellen die er elk twee hebben). Als die geslachtscellen met elkaar versmelten ontstaat de eerste cel van een kind. De vrouwelijke lichaamscellen hebben alle chromosomen in echte stellen van twee; daar is ook het stel x en x bij; maar de mannelijke hebben een x-en een y-chromosoom, en hun geslachtscellen kunnen dus of een x of een y hebben, terwijl de vrouwelijke geslachtscel altijd een x heeft. Als een y-dragende zaadcel met een eicel versmelt ontstaat dus een zoontje, en een x-dragende zaadcel maakt een dochtertje. Laten we nu eens het x-chromosoom met de afwijking x′ noemen, waarbij de′ dan het zieke dna-molecuul voorstelt. De lichaamscellen van een meisje waar een zo'n verandering in voorkomt hebben dan het chromosoomstel xx′. Dat is niet erg voor haar: wel kan het zieke chromosoom de boodschap om dat bepaalde eiwit te maken niet over zijn lippen krijgen, maar dat doet het andere chromosoom wel voor haar, overal waar dat binnen haar nodig is. Stel nu dat ze met een volkomen gezonde jongen trouwt. Hij heeft een stel chromosomen dat xy heet. Elk van zijn zaacellen zal een x of y hebben. Maar hoe staat het met haar eicelletjes? Zij loopt rond met twee soorten: degene die een x
hebben gekregen, en degene die het met een x′ moeten stellen. En op een goede dag blijkt ze een kindje te verwachten. Wat voor cellen zal dat dan krijgen? Als het een meisje is, in ieder geval met de normale x van haar vader, en met óf de normale óf de zieke van haar moeder. Haar lijfje zal dus xx of xx′ dragende cellen hebben. En als het een jongetje is? Dan moet de x van de moeder komen. En als het de zieke x′ is? Als dus het jongetje begonnen is in een x′ dragende eicel? Dan zal zijn eerste enige lichaamscel, en alle die daaruit ontstaan, het stel x′y hebben, en hij zal helemaal geen boodschap krijgen om dat bepaalde eiwit te maken. Het eiwit waar ik op het ogenblik aan denk is antihemofilitisch globine, of factor viii zoals het nu heet. En het jongetje dat geen boodschap krijgt om factor viii te maken is een hemofilie-
| |
| |
patiënt. Hij kan dus normale broertjes hebben, en al zijn zusjes zullen normaal lijken, zelfs als ze xx′ hebben, want dan zijn ze, zoals hun moeder, alleen maar ‘draagsters’ van de ziekte. Ik heb een prentje van de hele ramp getekend, figuur 27, en je kan daaraan verderbreien als je dat leuk vindt, en als je zelf niet zulke x′-chromosomen bevat.
Figuur 27.
Want dan is niet alleen de zekerheid erg; de onzekerheid is veel vreselijker. Het is makkelijk genoeg om een yx′ van een yx te onderscheiden: yx zal geen bloedtransfusie nodig hebben als hij eens zijn vingertje snijdt, en hoeft niet alleen maar met zacht speelgoed te spelen; een kies laten trekken zal niet gevaarlijk voor hem zijn; later mag hij met elk meisje trouwen dat hem liefheeft. Maar hoe weet je dat een meisje xx is en geen xx′? Voordat het te laat is? Er zijn heel wat bepalingsmethoden uitgewerkt om factor viii nauwkeurig te meten, in de hoop het verschil te kunnen vinden tussen normaal en net-nog-niet
| |
| |
normaal. Tot nu toe kunnen we daarmee niet beters zeggen dan dat gemiddeld de meisjes die draagsters zijn van hemofilie minder dan 100% van normaal gehalte aan factor viii hebben. Gemiddeld-dat is natuurlijk een volkomen waardeloze uitroep voor een enkel echt levend zusje van een hemofilielijder, of dochter van een vrouw die misschien, misschien ook niet, draagster van hemofilie is. Geen statistisch verschil van betekenis heeft enige betekenis voor het enkele individu. Uit jouw lengte kan ik niet duidelijk opmaken of je een mannetje of een wijfje bent, ook al zijn mannetjes gemiddeld langer dan wijfjes.
Eerlijk gezegd weten we niet eens zeker of factor viii werkelijk grotendeels afwezig is in een hemofilielijder, of aanwezig in een door mutatie verminkte gedaante; het is zelfs niet onmogelijk dat hij normale factor viii heeft plus een extra, abnormaal eiwit dat zijn factor viii tegenwerkt. Dan zou zijn vergissing dus in een heel ander dna-molecuul moeten zitten. Waarom zijn we zo stom dat we die abnormaliteiten niet van elkaar kunnen onderscheiden? Omdat de afwezigheid van zo'n eiwit geen zichtbare holte zou achterlaten. Met geen elektroforese of chromatografie kunnen we al iemands proteïnen zo mooi van elkaar scheiden dat we kunnen zeggen: ‘kijk, deze normale mensen hebben hier een streepje, en daar, het ontbreekt bij deze patiënt’ of ‘kijk nou eens, bij deze kerel zit het op een verkeerde plaats.’ Dat zou dan in het ene geval een tekort, in het tweede een verminking van factor viii betekenen.
Terwijl ik dit allemaal schrijf en vooral terwijl je dit leest merk je natuurlijk niet dat ik intussen aan allerlei patiënten denk. Maak dus maar eens een witbetegelde kamer om je heen. Je staat naast een wit bed, en merkt dat je ene hand in je andere knijpt, je staat er dus waarachtig handenwringend bij. Op het witte bed zit witjes een vierjarig jongetje met een groot onhandig verband om een hand, dat je zelf gemaakt hebt een paar uur geleden, toen hij thuis een klein sneetje in een vinger had gekregen, wie weet waarvan. Naast hem staat zijn twaalfjarig zusje bezorgd, maar gezond en volmaakt te kijken. Volmaakt of onvolmaakt? En dus gezegend of gestraft met vruchtbaarheid? Is ze een xx of een xx′? En moet ze dan ook zwanger worden en een kleine x′y krijgen? En net zo handenwringend naast een bed staan, haar jeugd door honderden kleine angsten verteerd? En haar geld, en tijd? En denk eens terug, aan al die vorige generaties van bloedende jongens en bange meisjes; dan kom je tenslotte bij de
| |
| |
eerste draagster, waar komt die dan vandaan? Misschien van een enkel proton dat eeuwen geleden een enkel dna-molecuul raakte en veranderde; dat is dan een oorzaak zo klein als een gedachte in je hersenen die onuitgedrukt vervaagt of als een die daar nooit meer uit verdwijnen zal. Want werkelijk, tegenwoordig wordt ons geheugen zo beschouwd, als een heel bouwwerk van kleine mutaties, misschien door protonen verwekt die via fijne zenuwuiteinden nucleïnezuren bekogelen en die dan voortaan met hun veranderde ladders veranderde boodschappen zullen doorgeven. Elk nieuw eiwit zal daar dan worden afgedrukt om je telkens opnieuw te herinneren aan die keer dat dat ene proton je precies daar raakte. Op die manier ben je dus een machine die door een enkel proton van plan en van handeling kan veranderen. Je bent een versterker. Maar een versterker waarvan? Wat erfelijkheid betreft, grotendeels van toevalligheden. Een kosmische straal van buiten onze atmosfeer steekt naar je toe en, als je daar toevallig net goed voor zit, raakt hij binnen in een van je cellen een proton dat dan een paar van je watermoleculen iets minder dan een duizendste graad verhit. Of er wordt binnen je hoofd een proton geraakt dat je een gedachte ingeeft die nergens vandaan schijnt te komen en die ongebruikt weer verdwijnt. Of een proton dat je tot een droom brengt die je nooit meer zal vergeten. Of, geraakt in een van je geslachtscellen, merk je niet eens hoe daar in een nog ongeboren kind een ziekte ontstaat die nog nooit heeft bestaan en die zich van jou uit over de hele wereld kan verspreiden. Een enkel proton dus wordt door jou heen een droom, of de ondergang van het menselijk ras, of niets. Dat noem ik pas versterking; en, eerlijk gezegd, zoiets in een patiënt ontdekken is te vreselijk, zo'n groot en onomkeerbaar onrecht, zo'n straf zonder misdaad is mij te groot om elke dag weer hulpeloos onder de ogen te zien. Ik ben geen medicus, maar een bioloog, en ik
graaf liever in feiten dan in werkelijkheid. Wie weet stuit ik dan toch nog wel eens op iets dat kan helpen in het werkelijke leven, en kan ik indirect meer doen dan ik ooit direct gedaan heb.
Misschien vraag je je af wat ik dan wel doe in mijn werk, en waar dat ooit voor kan dienen. Aan het eind van het eerste hoofdstuk beloofde ik al dat ik je daar iets van zou vertellen, en daar zal ik dan nu maar opgelucht aan beginnen.
| |
| |
| |
Monomoleculaire lagen
Het begon in 1947, toen ik een heel dik boek kocht omdat ik me eenzaam voelde. Er was een onbekend soort lente voor mij begonnen, in New Brunswick, een vreemd stadje in een vreemd land. Onbekende vogels vlogen aan uit onbekendere landen, daalden neer op naamloze planten en barstten uit in buitenlands gezang. Ikzelf had mijn meisje al zeven jaren niet gezien-sinds ik in een andere lente uit Nederland was weggevlucht, en er was ditmaal niets in de buurt te vinden behalve de lente zelf om haar in te herkennen. De robins leken vijfhonderd maal zo groot als fatsoenlijke roodborstjes en deden merels na, en de blue jays krijsten bijna zoals echte vlaamse gaaien; er waren zelfs mensen te zien die soms op iemand leken.
Ik had een klein Amerikaans kamertje gehuurd. Daarin zwegen de Amerikaanse dingen zodra ze mij zagen komen. Soms, voor ik naar mijn werk ging, liet ik een schrift open liggen of een oude brief ergens tegen leunen, of mijn oude legermes bovenop een potje marmelade in plaats van ernaast, in de hoop mijzelf te verrassen als ik 's avonds laat genoeg thuiskwam, maar nee, ik wist het dan meteen. Toen heb ik dus maar dat boek gekocht. Het woog ruim drie kilo, en zo kon ik dus wel vrij gretig mijn kamer binnenstormen om deze werkelijk voelbare bron van verbazing op mijn schoot te nemen. Het heette Medical Physics (Vol. 1, ed. Otto Glasser et al., Year Book Publications, Chicago, Illinois 1944). Er stond een hoofdstuk in van dr. H. Sobotka over het bestuderen van lagen die een enkele molecuul dik zijn. Het veranderde mijn leven zo aardig dat ik je er beslist iets van moet vertellen. Geen zorgen, we komen toch weer bij het bloed terecht.
Een manier om zulke lagen te maken is op water: maak eerst een soort van rechthoekig serveerblad en maak alle binnenvlakken daarvan waterafwerend (met paraffine bijvoorbeeld). Giet het ding overvol met een oplossing van een bariumzout in water, zo vol dat het oppervlak bol staat. Los in een buisje een beetje stearinezuur op in petroleum-ether, en laat daarvan zachtjes een druppel op het bolle bariumbad vallen. Die mengt zich niet met water maar verspreidt zich dadelijk over het hele oppervlak en de petroleumether-film verdampt meteen. De stearinezuurmoleculen, verspreid en onopgelost achterblijvend, hebben benatbare zure koppen en steken die haastig in het water, waar ze een nog minder oplosbaar zout vormen met de
| |
| |
bariumionen die ze daar oppikken. De staarten van de stearinezuur-moleculen zijn daarentegen hydrofoob en proberen dus zo ver mogelijk van het water weg te blijven, steken liefst door het oppervlak de lucht in. Al die nu bariumstearaat geworden moleculen, ronddolend als zeilbootjes, kan je bijeendrijven op allerlei manieren; door een draad

Figuur 28.
over het oppervlak te leggen en dan naar de overkant te sleuren, of een lat, of je kan een vlotje van boterhampapier of dun plastic maken dat de hele breedte van het serveerblad overbrugt en dat dan laten voorttrekken aan een draad die over een katrolletje loopt en aan zijn vrije uiteinde een klein gewichtje torst (zie figuur 28). Op deze manier kan je zien hoe het vlotje eerst plechtig voortglijdt en dan ophoudt alsof het door een onzichtbare veerkracht wordt tegengehouden, en dat is ook zo: het heeft alle stearaatmoleculen zo dicht op elkaar gedreven dat ze nu allemaal rechtop zij aan zij staan met hun staarten de lucht in. Dompel nu eens langzaam een hydrofoob gemaakt, spiegelend stukje plat metaal rechtop de stearaatlaag in. Dat is net als een vinger prikken in een grote zachte ballon: waar je zou duwen zou die meegeven en je vinger als die van een handschoen omstulpen. Kleefde die ook nog, en trok je dan je vinger terug, dan zou daarbij het zacht uitrekkend membraan zich tot een tweede laag om de eerste heen laten uitstulpen. Net zo gaat het met dat stukje spiegel: het is waterafwerend, dus het hydrofobe veld van stearaatstaarten zal daaraan vast blijven plakken bij het indopen en ook bij het weer ophalen, zodat een tweede laagje zich over het eerste heen vouwt (zie figuur 29). Zo zie je dat elke indoping je een dubbele laag moleculen geeft. Na tien keer dompelen begint je spiegeltje lichtgeel te zien, met nog een paar lagen bruinig, dan diep wijnrood, dan purper, violet, en dan
| |
| |
lichtblauw. Als je het spiegeltje die vier of vijf laatste keren telkens minder diep had gedompeld, zou je een bonte trap hebben gemaakt, waarvan elke trede anders gekleurd zou zijn en met een extra dubbellaag (twee keer de lengte van een stearaatmolecuul) overeenkomen. De kleuren zijn als die van een druppel olie, uitgespreid in een goot of

Figuur 29.
op de oceaan tot mooi geringde maar overigens onzichtbare, minder dan een millimeter hoge bergen. Je ziet kleuren doordat het gemengde zonlicht zowel door boven- als onderkant van de oliedruppel wordt weerkaatst. De lichtgolven die de lange weg kiezen-naar de onderkant en weer helemaal terug-zullen achtergeraakt zijn bij die welke meteen door de bovenkant werden teruggekaatst, en kunnen dus bijvoorbeeld golven ontmoeten waarvan de trillingsrichting op dat ogenblik net de omgekeerde is van hun eigen. Zo'n stel, dat je kan tekenen als twee lagen tegen elkaar in kronkelende slangen, heft elkaar op. Daar, en op alle olie van die dikte (dus in een ring rondom de top van de olie‘berg’) verdwijnt dus overal die ene golflengte, die ene kleur uit het witte zonlicht. Zo'n kleur, veroorzaakt door het verlies uit wit licht van kleur waarin interfererende stralen elkaar hebben vermoord, heet een interferentiekleur. Het zoete blauwgroen van sommige vogelhalzen en vlindervleugels is ook een interferentiekleur.
Dwars over het nu wild gestreepte spiegeltje kunnen we dan een druppel eiwitoplossing laten lopen, als een loper over de treden van een trap, en die dan weer afspoelen met verdund zout en dan water.
| |
| |
Daarbij merk je dat, terwijl de hele rest van de trap, nog steeds een dichte deken van naar de lucht wijzende stearaatstaarten, hydrofoob gebleven is, de baan van de eiwitoplossing hydrofiel, benatbaar, is geworden. Laat je die uitdruipen en drogen, dan kan je zien hoe de eiwitdruppel werkelijk een loper heeft achtergelaten die ongeveer zo

Figuur 30.
dik kan zijn als een trede, want elke trede heeft daar een andere kleur van gekregen die ongeveer overeenkomt met de oorspronkelijke kleur van een trede hoger (figuur 30). Met andere woorden: er is een laag eiwit achtergebleven die zo dik is als twee stearaatmoleculen, en dat is twee maal 24 ofwel 48 Ångström. De lengte van een stearaatmolecuul was al lang geleden op andere manieren berekend. Wat heb je nu gebruikt voor het meten van iets zo dun dat geen microscoop het nog zichtbaar kan maken? Een serveerblad, een touwtje, een stukje metaal, een paar goedkope chemicaliën. Langmuir, die dit trucje en nog veel andere bedacht heeft, werkte meestal met touwtjes, was, smeerolie van precies de juiste ouderdom, en een raam op het noorden. Ik ontdekte de naam van deze merkwaardige man te laat: toen ik eenmaal de moed kreeg om hem op te bellen kwam hij al nooit meer op zijn lab, was buiten bezig te proberen regen te maken,
| |
| |
en had zich voor ik het wist op zijn grootste en eenvoudigste proef geworpen: het sterven. Ook de kans om grote dingen te ontdekken met kleine middelen is daarmee misschien gestorven. Wel heb ik zelf ook eens iets op een eenvoudige manier ontdekt: als ik mijn adem liet condenseren op zo'n stukje spiegel, dan besloeg dat het wittigst

Figuur 31.
waar de oppervlakte het hydrofoobst was, en leek de eiwitlaag er dus zwart op. Daarna ontdekte ik iets nog belangrijkers: dat diezelfde eenvoudige proef al twintig jaar eerder was beschreven. Door Langmuir natuurlijk.
Maar toen ik dat dikke boek nog zat te lezen, met de magere oorlogsjaren toch al zo vol stukjes armzalig touw, en scherfjes spiegelglas om mij in te scheren, toen geloofde ik nog het gretigst dat ik mij alleen maar boven de conclusies van Langmuir zou kunnen verheffen op de duurste manieren: met een of andere grote machine. Niet zo maar een: een die precies kon laten zien wat bloed-proteïnen aan oppervlakken uitvoeren; om te beginnen wou ik die kleurverandering, veroorzaakt door eiwitlopers op stearaattrappen, dolgraag door het oog van een machine zien gebeuren. Ik ontdekte dat er waarachtig in New York twee van die machines waren en dat ze ellipsometers heetten. Daarin filtreert een polarisator het licht van een kwiklamp zo dat het in een plat vlak trilt. Als zo'n speciaal spiegeltje van ons
| |
| |
dat terugkaatst, verwringt het daarbij dat trillingsvlak tot een platte spiraal waarvan de eigenschappen gemeten kunnen worden en afhankelijk zijn van de dikte van het laagje op onze spiegel. Waarom is te ingewikkeld voor mij, maar figuur 31 laat je wel ongeveer zien hoe.
Over zo'n dure machine kon ik alleen maar dromen, als ik bijvoorbeeld
Figuur 32.
na mijn werk, achter het hospitaal in een verwilderd stuk land op mijn rug lag. Maar ik zag niets anders dan de zomer die voorbijging, dat begreep ik wel toen het eerst nog zo verse onkruid plotseling manshoog werd en zich vergrauwende loswiegde om zich op mij te storten. Een hele lente en zomer ongevangen en toch ongetrouwd voorbij zien gaan, dat was meer dan genoeg. In september kwam Tineke over en we trouwden de dag daarna, met een vriendin en twee in nogal gevlekt wit getooide ziekenhuisassistenten als getuigen en publiek; de esdoorns werden rood, de goudvinken en scarlet tanagers trokken naar het zuiden en werden vervangen door junco's en door een fabrikant van ellipsometers. Hij zocht ons op in ons lab, dat toen bestond uit een halve kamer die we soms mochten gebruiken. De andere helft bestond uit een bed waarop vaak een patiënt onderzocht lag te worden. Lag die er niet, dan legden wij daar een plank om als tafel te gebruiken. De bezoekende fabrikant, voor wie we de plank tegen een muur hadden gezet zodat hijzelf op het bed kon zitten, zal
| |
| |
wel begrepen hebben dat onze belangstelling voor zijn machine van elfduizend dollar nogal theoretisch was. Maar tien jaar later werkte ik in dat stollingslab van het Mount Sinai Hospital, en de kamer van dr. Sobotka met zijn ellipsometer was daar vlak naast. Die twee, en hun medewerkers, hielpen mij bijzonder aardig, en de enkele proefjes die ik daar deed met hun niet-registrerende machine waren zo verwarrend dat ze veelbelovend konden genoemd worden. Zodat ik eindelijk, na nog eens vijf jaren ouder te worden, in het Veterans Administration Hospital kon beginnen te werken door eerst om een ellipsometer helemaal voor mij zelf te vragen. En nog bijna een jaar later, daar was hij.
Ondertussen had ik een keer een neef van me opgezocht die in de Bell Telephone Research Laboratories werkte. Hij liet me toevallig wat glazen plaatjes zien die hij eerst met een laagje tantalium bedekt had en toen geanodiseerd. Daardoor werd op het spiegelend oppervlak een laagje oxyde afgezet waarvan de dikte afhing van het voltage waarbij het gevormd was, en dat zo dun kon zijn dat het prachtige en controleerbare interferentiekleuren vertoonde. Dat was precies wat ik nodig had: een onverwoestbaar oppervlak met precies dat soort optische eigenschappen van de teder met bariumstearaat bedekte spiegels, die altijd maar één keer konden worden gebruikt.
Ook het toestel was heel mooi. Toen het eenmaal naar binnen was gereden, uitgepakt, opgesteld en ingeschakeld, toen de kwiklamp aanging en kleine lichtjes weerkaatste in het dofglanzende metaal en het grijze gehamerde email, en toen het violette plaatje daar midden in zat, in de cuvette, en toen daar de heldere vloeistof voorzichtig door een glazen spiraaltje in werd gemengd en traag uit de naden van de cuvette begon te lekken die tenslotte uit elkaar viel-dat was niet zo best natuurlijk, maar we hadden verder heel weinig problemen, eigenlijk. Het moeilijkst was, dat de wijzer van onze lichtmeter telkens stuipte als er maar een klein stofje langs het weerkaatsend spiegeltje zweefde; dat maakte het moeilijk om de stand van die wijzer met kleine tussenpozen af te lezen en op te schrijven. Het werd nodig een registreerapparaat te kopen dat van al die schommelingen een min of meer dikke, maar duidelijke curve zou kunnen tekenen. Een jaar later hadden we dat ook al.
Intussen had de wereld van de stolling niet stilgestaan. Toen ik voor het eerst van ellipsometers hoorde, was factor ix de nieuwste
| |
| |
ontdekking. Toen ik in Mount Sinai begon, waren factor x en xi een paar jaar oud en was het eerste artikel over factor xii net verschenen. Dus al mijn oudere pogingen om uit te vinden wat een oppervlak deed met bloed, voordat mijnheer Hageman was ontdekt, waren zo vruchtbaar geweest als het zoeken naar een paard in een hoefafdruk. Tegen de tijd dat mijn toestel begon te registreren, hadden anderen al aangenomen dat bij de eerste aanraking van plasma met glas, factor xii daarop ging zitten en dat factor xi zich dan op de geactiveerde xii vasthechtte waarna het complex xii-xi zich misschien wel los zou maken van het glas.
De eerste curve die onze machine maakte-werkelijk de eerste, want de man die het registreertoestel met de ellipsometer had verbonden zat daar zelf ook nog praktisch aan vast-moest er een van normaal plasma zijn, vonden we. We draaiden de lamp aan, zetten een (niet lekkende) cuvette met bufferoplossing in de lichtbaan, klemden daar een van onze spiegeldingetjes in, zetten de roerder aan, keken door de telescoop, regelden zeven knopjes, twee wielen met schaalverdelingen, een hefboompje, een schakelaar, en keken naar de pen die een nogal bemost maar toch vrij vlak grasveld begon af te tekenen, deden toen een paar druppels intact plasma bij de bufferoplossing en keken weer naar die pen. Eerst schetste hij een bundel biezen en toen, heel vlug, een steile berg die haastig en toen steeds langzamer steeg,-was dat factor xii die bezig was geadsorbeerd te worden? En toen, waarachtig, begon die berg traag te dalen zodat er na een half uur nog maar drie kwart van hem over was (figuur 33): was dat het weghalen van factor xii door factor xi??
Dat was natuurlijk veel te mooi om waar te zijn-maar binnen twee weken konden we elkaar laten zien dat normaal intact plasma altijd zulke curven gaf. En als we het plasma eerst met glaspoeder schudden en dan centrifugeerden, zodat het al zijn avonturen met glasoppervlakken al achter de rug had, dan liet zo'n plasma ook nog wel een berg van adsorptie zien, maar daarna geen daling meer, zelfs niet als we wat vers, intact plasma bij de oplossing goten. Waarschijnlijk had het glaspoeder zoveel factor xi en xii weggeadsorbeerd dat daarna in ons toestel andere eiwitten een kans kregen geadsorbeerd te worden. Later stuurde een vriendelijke dokter ons weer eens een patiënt met factor xii-gebrek. Met het plasma van deze jongen tekende onze ellipsometer een berg die tot een plateau steeg en daarna niet wou
| |
| |
dalen: adsorptie dus weer, zonder desorptie. Pas toen we wat van het zuiverste factor xii-preparaat van de wereld (van dr. Ratnoff) erbij deden, begon de berg, na korte aarzeling, te dalen. We konden ook het gebrekkige plasma van tevoren met factor xii mengen om het compleet te maken; dan gedroeg het zich in de machine als normaal

Figuur 33.
plasma, eerst een berg van adsorptie vertonend, dan de langzame desorptie. Fijn hè? Maar klopte een van de proefjes die je nu net las eigenlijk wel precies met de theorie? Denk maar eens na.
Heb je alles precies uitgeplozen, en iets van een verkeerde volgorde ontdekt, dan kan ik je nog iets veel akeligers vertellen. Vlak voordat ik dit gedeelte, in het Engels, geschreven had, begon ik namelijk proeven te doen met antisera. Die worden gemaakt door bijvoorbeeld konijnen met gezuiverde menseneiwitten in te spuiten; de verbaasde dieren maken dan zelf eiwitten die specifieke verbindingen maken met de ingespoten soorten eiwitten. Wij kochten dus anti-mensenfibrinogeen-serum dat door konijnen was gefabriceerd; en ja hoor, als we op een van onze spiegelende plaatjes eerst fibrinogeen afzetten, en daar dan antifibrinogeen-serum bij deden, tekende de machine een geweldige berg; op andere eiwitlagen werd geen antifibrinogeen afgezet.
| |
| |
Maar wel op een laag die door normaal plasma was afgezet; dat zo'n plasmalaag wel antifibrinogeen aantrok kon alleen maar betekenen dat de laag zelf fibrinogeen bevatte, zelfs een heleboel, volgens onze berekeningen. Nog voordat de plasmaberg begon te dalen, wilde hij al niet meer met antifibrinogeen reageren; dat hebben we net ontdekt, en dat moeten we nou ook al weer publiceren. Ik heb er al een lezing over gehouden. Met dr. Marjorie Zucker, die men best de Koningin van de Bloedplaatjes zou kunnen noemen, heb ik toen een paar eenvoudige proefjes gedaan die je ook zelf kunt verzinnen. Ik wou kijken of ook op glas, bloed eerst fibrinogeen afzet en dan weer door iets anders vervangt, en tegelijk wilden we weten of plaatjes aan fibrinogeen vastplakken. Wat deden we?
We lieten een druppel normaal plasma twee minuten op glas zitten, hielden dan de glasplaat schuin zodat de druppel begon neer te glijden, hielpen hem toen bergaf met een zacht straaltje bufferoplossing, wasten alles toen zachtjes af, legden het glaasje vlak en bedekten het met een suspensie van normale bloedplaatjes in plasma van de patiënt die geen fibrinogeen had. Een half uur later wasten we het geheel zorgvuldig met buffer, fixeerden en kleurden het preparaat, en zagen toen onder de microscoop-wat? Dat de plaatjes in grote menigten vastzaten op de baan die de druppel onder het neerdruipen had achtergelaten, maar dat op de plaats waar diezelfde druppel twee minuten had doorgebracht, maar heel weinig plaatjes vast waren gaan zitten. Op het ogenblik, en volgende week misschien al niet meer, denk ik dat op dergelijke oppervlakken dus het volgende gebeurt: het plasma zet eerst fibrinogeen af; daaraan blijven de bloedplaatjes die toevallig in de buurt komen, kleven; elders wordt het fibrinogeen door ander eiwit, onder andere factor xi of xii, vervangen; daarvan wordt dan door factor xii of xi een deel weggenomen.
Het kan ook wel dat er nog een heel ander systeem schuldig is aan desorptie. We hebben namelijk een stof in ons plasma die plasminogeen heet; hij wordt misschien door actieve factor xii omgezet in plasmine, en dat is een eiwitverterend enzym met grote eetlust voor fibrinogeen. Wie weet dus. En dan is er nog een troep stoffen die complement heten, en daarvan kan er ook een, bah, ik schei ermee uit. Maar het kan best zijn dat ze allemaal werken aan het afzetten en het oplossen van plaatjeslijm, wat dat dan ook is. Over complement hoor je later nog wel.
| |
| |
| |
Hemoglobine
Ik heb je misschien de indruk gegeven dat de erfelijke eiwitabnormaliteiten-de mutaties die vaak ‘moleculaire ziekten’ worden genoemd -altijd minstens een van deze twee vragen onbeantwoord laten: 1) is er een eiwit afwezig, of is het er wel maar zo abnormaal dat het niet werkt (onbeantwoord bij hemofilie) en 2) is de abnormaliteit (of het gebrek) werkelijk van belang voor het lichaam dat ermee rondloopt (onbeantwoord bij gebrek aan albumine of factor vii)? In het mistige veld van de bloedstolling is ons excuus dat al die eiwitten, behalve fibrine, onzichtbaat zijn, en dat we dus alleen iets kunnen vinden door er per ongeluk in te trappen en uit te glijden. Mensen die met de hemoglobines werken boffen: daar hebben ze tenminste een fraai geverfd eiwit, keurig opgesloten in rode bloedcellen die gecentrifugeerd kunnen worden, dan met zoutoplossing gewassen, en dan gebroken zodat ze een 30% sterke oplossing van het rode goedje loslaten. Er is maar een klein beetje in rode cellen dat geen hemoglobine is en dat beetje is niet rood. Geen wonder dus dat hemoglobine gekristalliseerd kon worden en toeliet om met ingewikkelde maar elegante methoden zijn vorm te bepalen.
Normaal hemoglobine, dat hemoglobine a (of kortweg Hb a) genoemd wordt, lijkt hoop ik op het volgende schetsje. Het zit als een stel Siamese tweelingen in elkaar, elke ling met een moleculair gewicht

Figuur 34.
| |
| |
van 33000 (maal het gewicht van een waterstofatoom), en ongeveer driehonderd aminozuurgroepen bevattend. Die driehonderd vormen samen twee ketens, alfa en bèta geheten, zodat het hele molecuul twee alfa- en twee bètaketens heeft. In de ‘vingerafdrukken’ (zie pag. 57) van de twee best bekende abnormale hemoglobines,

Figuur 35.
Hb s en Hb c, is te zien dat ieder alleen maar van a verschilt in één aminozuurgroep van hun bètaketens. Op de plek waar a een hydrofiele groep heeft, die glutaminezuur heet, heeft s een hydrofoob aminozuur dat valine heet. Je (of men tenminste) kan Hb stuk maken zodat je vier losse ketens hebt, en dan, bijvoorbeeld, aan elke keten een radioactief atoom hangen. Stel dat je dat met een beetje Hb a doet, en in een ander buisje breek je wat Hb s in vieren zonder daar iets radioactiefs bij te doen, en dan de twee mengt. Onder de juiste omstandigheden krijg je dan allerlei nieuwe combinaties; een daarvan is Hb s maar met radioactiviteit aan zijn alfaketens. Wat bewijst dat?
Het bevestigt dat de alfaketens in Hb s normaal zijn. Het is dat ene hydrofobe aminozuur in de bètaketens, daaruit komen alle rampen voort. Bij lichaamstemperatuur zijn de hydrofobe banden namelijk sterk, zodat daar die zieke valine-groep door het omringende water waarschijnlijk gedwongen wordt een zieke hydrofobe band te leggen met een andere, gezonde valine-groep ergens anders in het Hb s-molecuul, en die zieke band verwringt het hele molecuul zo dat het ineens precies tegen andere Hb s-moleculen past, vooral als ze net hun zuurstof hebben losgelaten zoals dat moet wanneer ze door zuurstof-hongerige weefsels reizen. Daar zullen dan de Hb s-moleculen in de rode cellen zich opstapelen tot geweldige bundels, eigenlijk lange, rode kristallen, die zo in de tedere rode-celwanden priemen dat daarvan de cellichamen sikkelvormig worden (figuur 35). De sikkelvormig geworden cellen haken dan vaak tot ellendige trossen aan elkaar,
| |
| |
de bloedvaten verstoppend en soms daardoor de weefsels verstikkend tot de dood volgt.
Maar alles is nooit helemaal verschrikkelijk, en vooral niet als je Hb s erft van maar één ouder. Misschien herinner je je nog dat je voor elke ‘eigenschap’ in het algemeen waarschijnlijk twee genen krijgt:

Figuur 36.
een van je vader, en een van je moeder. Als die twee genen precies op elkaar lijken, kun je jezelf homozygoot noemen voor die eigenschap. Anders ben je heterozygoot. Nou dan, patiënten die de sikkelcel-ziekte hebben, zijn homozygoot; je kan ze ss noemen. Maar mensen die alleen maar de ‘trait’, de neiging hebben, zijn heterozygoot, want een van die twee genen is normaal; je kan ze dus sa noemen. Elektroforese van hemoglobine uit een aa-mens gehaald, geeft je maar een enkele streep, en ook hemoglobine van ss-mensen, maar op een andere plek; sa-mensen daarentegen geven je twee banden, een op de plek van s en een op de plek van a (zie figuur 36). Dat ene abnormale aminozuurgroepje in s verdraait het molecuul blijkbaar voldoende om het een andere snelheid te geven in een elektrisch veld.
De mensen met sa kunnen onder één bepaalde omstandigheid van geluk spreken. In bepaalde streken van Afrika komen ze daardoor veel algemener voor dan verwacht hoort te worden. De oorzaak
| |
| |
daarvan is (waarschijnlijk) dat daar minder sa- dan aa-kinderen sterven aan een ernstige vorm van malaria die daar voorkomt. Blijkbaar beschermt de s in het sa-mengsel ze. Hun geluk is natuurlijk maar betrekkelijk: het zou niet eens gemerkt zijn als toevallig de gelukkigen die geen s hebben niet iets nog akeligers boven het hoofd had gehangen. Zoals de toestand daar nu is, kan je dit zeggen: als een as-jongen trouwt met een as-meisje kunnen ze normale aa-kindjes krijgen die grote kans lopen aan malaria te sterven, of ss-kindjes die van het sikkelen dood zullen gaan, of as-kindjes die, tenminste zo lang die malaria heerst, alle andere overleven.
| |
Trombose en de Hageman-factor
Het is best mogelijk dat de mensen die met gebrek aan Hagemanfactor rondlopen, nog meer boffen dan de Afrikaanse as-kinderen. Uit hoofdstuk i weet je al dat mensen met Hageman-gebrek wel een lange stollingstijd hebben maar toch nooit aan bloedingen lijden. Omdat ze zo gezond zijn dat velen van hen waarschijnlijk rondspringen zonder ooit onderzocht te worden, hebben we nog niet genoeg gevallen bij elkaar om uit te vinden of ze gemiddeld misschien zelfs langer leven dan normale mensen. Een van de voornaamste oorzaken van hartziekte is namelijk trombose van de coronaire bloedvaten-de vaten die zuurstofrijk bloed tot diep in de hartspieren brengen. Trombose is het groeien van een trombus-een afschuwelijk gevormd echt dingetje, waarnaar pathologen in ieder lijk gretig zoeken. Ah, roepen ze dan en houden het voorwerpje triomfantelijk in de hoogte. Het ziet er uit als een levend, parasitisch, naakt slakje, met een stevige grijze kop van samengepakte bloedplaatjes (de ‘witte trombus’) en een zachte rode staart, eigenlijk een afgietsel van het bloedvat, uit fibrine en de daarin gevangen rode cellen gebouwd (de ‘rode trombus’). Van zo'n ondubbelzinnige vondst kunnen zelfs veel geleerden het niet laten een ondubbelzinnige oorzaak te eisen. ‘Het ding is net een stolsel, de patiënten stollen dus te makkelijk’ juichen de stollingskundigen. ‘Het ding begint met een kop van bloedplaatjes die aan elkaar klonteren, de patiënten hebben beslist een verhoogde klonterlust van de bloedplaatjes!’ brullen de bloedplatologen. ‘Die kop begint altijd ergens op een ziek plekje van de bloedvatwand; de patiënten krijgen dus alleen maar trombose doordat zelfs gezonde plaatjes
| |
| |
op een ziek plekje blijven steken!’ krijsen de bloedvatwandelaars. En ieder met een voldoend kleine theorie weet altijd wel een even klein bewijs te vinden. Ikzelf bijvoorbeeld zou op het volgende willen wijzen: a) sommigen zeggen dat plaatjes kleveriger worden als Hagemanfactor geactiveerd is; en b) mensen die bezig zijn een trombus te vormen, hebben vermoedelijk geactiveerde Hageman-factor in hun bloed. Hoe die zo geactiveerd is geraakt, dat is weer iets anders. Beslist niet door contact met glas. Misschien door een of ander enzym. Of door wat vetzuurmoleculen die zich om rare redenen niet met albumine hebben onschadelijk willen laten maken. Als dat allemaal zo is, mogen mensen zonder Hageman-factor in ieder geval geen trombussen maken. Helaas moet ik je meteen vertellen dat kort geleden in een hospitaal hier vlak bij, een man werd binnengedragen met een hartaanval. Hij moest onmiddellijk met stollingsvertragende middelen behandeld worden, dus werd eerst, als controle, een stollingstijd op hem gedaan. Die was meteen al veel te lang. De gekke Vroman werd erbij geroepen. Hij meteen proberen welk van de abnormale plasma's in zijn collectie niet door het plasma van deze man werd gecorrigeerd: warempel, dat zonder Hageman-factor. Later kon dr. Ratnoff bevestigen dat het plasma van deze man bijna helemaal geen Hageman-factor had. Nu blijft de vraag, gelukkig, of deze patiënt en ook twee andere die kort geleden gerapporteerd zijn, werkelijk trombussen in hun hartvaten hadden, want ze zijn alle drie nog flink levend. Misschien hadden ze kluitjes van iets anders. Misschien ook missen ze een natuurlijke bescherming tegen fibrine- (en dus rode trombus-) vorming. Ik zei immers een paar pagina's eerder dat normale mensen een eiwitverterend enzym, plasmine, kunnen maken uit plasminogeen met behulp van geactiveerde Hageman-factor. Die drie patiënten konden dat waarschijnlijk niet zo goed. Toch, het blijft mogelijk dat ze geen fibrine maar
vetpropjes of zoiets hadden gevormd, en zolang ze nog leven, leeft ook de theorie dat mensen met gebrek aan Hageman-factor beter zijn dan normalen, omdat ze minder kans hebben op echte trombose en hartverlamming, ziektes die tegenwoordig zo toenemen dat de Normalemannen binnenkort te jong zouden kunnen sterven om zich eerst voort te planten; dan zullen de Hagemannen de wereld veroveren.
De nutteloze vraag wordt dan: waar heeft Normaleman ooit dat nutteloze eiwit, Hageman-factor, opgelopen? Het antwoord moet
| |
| |
miljoenen jaren achter ons liggen, in de tijd dat we, afgedwaald van de slappe, ruggegraatloze beesten, het droge, angstaanjagende vasteland op vluchtten. In die dagen, of liever in die dieren, werden nog bij de aanraking van bloed met vreemde oppervlakken hele bloedcellen betrokken en niet alleen maar wat opgeloste moleculen. Zulke cellen, die werkelijk uit elkaar spatten bij aanraking, noemen we trombocyten. Ze konden, en kunnen nog in veel diersoorten, wonden afsluiten net zoals onze bloedplaatjes dat doen, maar hebben echte kernen en lijken meer op amoeben. Is er iets in die bijna zelfstandige cellen dat al gevoelig genoeg voor aanraking is om een of ander soort stolling aan de gang te krijgen? Ja hoor, heel wat. Er zijn amoeben die ‘leegbloeden’ als ze in een oplossing van heparine worden gebracht en dan gewond. Heparine remt de stolling van alle soorten bloed. Een amoebe uit de oceaan lekt dood als we het calcium uit zijn normale wereld wegnemen. Ook ons bloed heeft calcium nodig om te stollen. En als een amoebe ‘stolt’ schijnt het een enzym te vormen dat in sommige opzichten op ons trombine lijkt. Dat is allemaal al aardig, maar niet door mij ontdekt. Ikzelf daarentegen verbeeld me dat ik een delicatere familietrek gevonden heb die we met amoeben delen. Daar moet ik nu dus wat meer over zeggen.
Eerst even terug naar mijn geliefde zigzagsysteem van de stolling, dan kan ik voortbreien aan wat ik op pag. 68 zei: apolaire, dus meer waterafwerende, eiwitmoleculen, zei ik toen, kunnen zich in aanraking met een hydrofoob oppervlak waarschijnlijk openen en zich met hun vette harten over dat vette vlak uitsmeren. Nu begint mijn zigzag juist met een hydrofiel en niet met een hydrofoob oppervlak. Maar dat hindert niet, want we kunnen een eiwitmolecuul ook het omgekeerde laten doen: met zijn hydrofiele groepen zich over een hydrofiel oppervlak uitspreiden en daardoor zijn hydrofobe hart aan de wereld ontbloten. Stel dat factor xii dat doet, en dus ‘geactiveerd’ wordt terwijl het zich zo opent, en stel dat factor xi een meer ‘hydrofoob’ eiwit is, waarvan het vette binnenste wordt aangetrokken door de nu beschikbaar geworden vette groepen van de geadsorbeerde en geactiveerde factor xii. Factor xi hecht zich dus met zijn vetheden door middel van hydrofobe banden vast aan xii; daar liggen ze met hun vette buikjes tegen elkaar aan, maar nu is het benatbare ruggetje van xi precies in de goede houding om een aantrekkelijk elektrisch patroon van ladingen te maken voor factor ix en calcium. Enzovoort.
| |
| |
Of, volgens de school van Seegers de factoren ix, x en trombine als onderdelen van een enkel molecuul, protrombine beschouwend (aangegeven door de worsterige omtrek in figuur 25), kunnen we zeggen dat het intacte protrombine door steeds hydrofobere moleculen wordt aangevallen, die er telkens stukken afbijten en tenslotte het hydrofobe hart zelf van protrombine, trombine namelijk, ontbloten.
Ik had me zoiets al in 1963 voorgesteld, en gepubliceerd. Een paar jaar later werd ik door dr. Ratnoff opgebeld, helemaal vanuit Cleveland, Ohio; hij vertelde dat zijn gezuiverde Hageman-factor minder oplosbaar in water wordt als het geactiveerd is. Hij heeft namelijk een manier ontdekt om het zonder gebruik van een vast oppervlak te activeren. Dat klopte prachtig met mijn idee: minder oplosbaar worden, dat betekende waarschijnlijk ook meer hydrofobe groepen beschikbaar hebben. ‘Dat meen je niet!’ riep ik dan ook uit. ‘Ik meen altijd alles,’ antwoordde hij ernstig. En helemaal vanuit Cleveland, dat maakte het belangrijk genoeg om tenminste gedurende de eerstvolgende alinea's in mijzelf te geloven.
Nu weg weer van de zoogdierenstolling en terug de cel in. Daar zijn vijftig jaar geleden, en vooral twintig jaar geleden, wat mooie proeven binnen gedaan. Zo ongeveer:
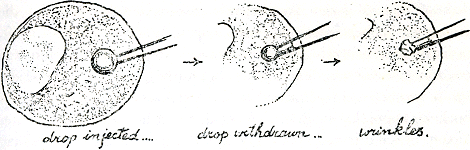
1. Je kijkt door een microscoop naar een cel en prikt daarin met een heel fijne injectienaald, waardoor je dan een druppel olie langzaam midden in die cel inspuit; zorg dat de druppel aan de open punt van de naald blijft zitten en zuig er na een poosje wat van in de naald terug. Dan zie je de druppel eerst natuurlijk kleiner worden, maar dan, in plaats van nog kleiner te worden, begint hij te kreukelen.
2. Doe dit alles ook eens met een andere cel, maar bezeer die eerst ergens, niet op de plek waar je van plan bent de naald in te steken. Ditmaal zal je zien dat de druppel nauwelijks kleiner behoeft te worden of hij slaat al aan het kreukelen.
3. Nog eens dezelfde proef als in nummer 2, maar ditmaal wacht je een poos na de cel beschadigd te hebben; dan pas spuit je de oliedruppel in. Nu moet je heel wat van de druppel terugzuigen voordat hij rimpels begint te vertonen, meer zoals dat in proef 1 moest. Zie figuur 37.
Dit wordt allemaal ongeveer zo uitgelegd: in 1 werden allerlei meer of min apolaire celeiwitten geadsorbeerd op het vette oppervlak van de oliedruppel. Toen die werd teruggezogen en zijn oppervlakte
| |
| |
dus kleiner maakte, vonden de minst apolaire en de meest elastische van de geadsorbeerde moleculen het best om zich weer los te laten en zich terug te kronkelen in hun oude gedaante; weer met hun meest benatbare aminozuurgroepen om hun vette hartjes gevouwen gingen ze graag terug in de waterige wereld van het cellichaam. Tenslotte
Figuur 37.
werd de druppel zo klein dat de meest apolaire eiwitmoleculen-die welke zich altijd onherroepelijk binnenste buiten moeten keren als ze een waterafwerend oppervlak omhelzen-geen ruimte meer over hebben, tegen elkaar aangepakt worden, en vastgeklampt aan het oppervlak, kromtrekken en knakken, en kreukels maken.
In proef 2 veroorzaakte het kleine plekje schade dat je aanbracht, een verandering die meteen door het hele cellichaam werd voortgeplant; je verstoorde een nogal onzichtbaar ruimtegaaswerk van eiwitten, vetachtige stoffen en nucleïnezuurmoleculen, en veroorzaakte daardoor een inwendige motregen van de meest breekbare, apolaire eiwitmoleculen. Die werden dadelijk, toen je zo gauw je oliedruppel inspoot, aangetrokken door dat vette oppervlak, waar ze zich meteen binnenste buiten keerden en zich stijf uitstrekten, elkaar daarbij zo verdringend dat ze moesten knakken en de oppervlakte kreukelen, nog voordat die verkleind werd.
In nummer 3, tenslotte, had je zo lang gewacht na de cel beschadigd te hebben, dat al die arme vrijgekomen ‘apolaire’ eiwitmoleculen andere hydrofobe plekken moesten vinden in plaats van de afwezige oliedruppel, om zich aan vast te klemmen; vele zetten zich waarschijnlijk met hun vette buikjes tegen die van hun lotgenoten vast of raakten betrokken in het stollingsproces van de cel. Toen de oliedruppel eindelijk verscheen, waren nog alleen de onverschillige eiwitsoorten over om zich lusteloos op het olievlak neer te vlijen, en
| |
| |
toen je dat oppervlak kleiner maakte, lieten ze zich zonder gezeur los, rolden zich weer in hun oude natte gedaante op en doolden weg, de dode celwereld in. En de druppel kreukelde niet.
Waar huilde het gescheurde web in de cel zulke vette tranen vanals het dat tenminste deed? Misschien hielp de scheur wel, die je in het buitenste membraan van de cel gemaakt had. Want in het volgende hoofdstuk zal je zien dat celmembranen fosfolipiden bevatten; die moleculen hebben ieder een polaire kop zoals een vetzuur die heeft, maar dan met fosfor erin, en een paar lange, vette, apolaire staarten. Van een zootje fosfolipide-moleculen, in het water gesmeten, zullen dadelijk de staarten met hydrofobe banden aan elkaar kleven, en alleen het boeketje koppetjes zal elektrisch geladen naar het omringende water kijken. In een celmembraan zullen ze wel in een vlakkere dubbellaag moeten liggen, net zo als de dubbele lagen bariumstearaat op de ingedompelde voorwerpglaasjes van pagina 83. Je zou twee van die dubbellagen kunnen beschouwen als de sneden brood van een sandwich met de eiwitten van het membraan als belegging ertussen. Als je die dwars doorsnijdt, druipt niet alleen maar de belegging er tussenuit, de dubbellagen van fosfolipide vallen zelf ook uit elkaar, tot kleine holle bolletjes met dubbele of enkele wand. Die worden micellen genoemd, zoals ook de eenvoudige boeketjes die we daarnet beschreven. De eiwitmoleculen lijken zelf elk ook wel wat op micellen, met hun vette harten. Je kan je dus voorstellen dat twee micellen, waarvan één een eiwitmolecuul is bijvoorbeeld, elkaar naderen, en als het eiwit van de soort is die zich makkelijk binnenste buiten keert, zal het dat kunnen doen en zijn vette hart zal dan dat van de fosfolipidemicel door de zachte huid van koppetjes heen zoenen tot alle beschikbare hydrofobe groepen met hydrofobe banden aan elkaar geplakt zitten. Sommige fosfolipidemoleculen zullen daarbij uit hun micel wegbreken en zich de vette binnensten van andere eiwitmoleculen binnenwringen, die daar op hun beurt van opengaan.
Hoe toevallig datje mijn zigzagschema van het stollen bijna net zo kunt beschrijven. Telkens als daarin een pijl naar rechts gaat is daar een reactie die door vetzuur of fosfolipide geholpen wordt. En hoe toevallig dat factoren viii en v, die volgens mij het meest ‘apolair’ zijn, doodgaan als ze eenmaal gereageerd hebben, net zoals de meest apolaire eiwitten in een cel, die na beschadiging van de cel zo kort zo actief zijn en dan sterven.
| |
| |
Er is een goedje te koop dat je uit praktisch allerlei onderdelen van dieren kunt extraheren. Het is een nogal gestorven mengseltje van fosfolipiden en eiwitten en we noemen het ‘tromboplastine’, want het is in staat, onder gunstige omstandigheden trombine uit protrombine te maken in minder dan vijftien seconden. Ik geloof dat het tromboplastine eigenlijk niet zo maar in de weefselcellen voorkomt maar dat het gevormd wordt in de paar seconden terwijl we het weefsel fijnmalen om ons extract te prepareren. Hoe kunnen die cellen dat dan zo vlug? Doordat ze niet alleen omgeven zijn met een membraan, maar ook inwendig doorspekt zijn met membraanplooien en blaasjes. Een speldeprik doorpriemt meteen hele stapels van die sandwiches. Als je in je huid wordt geprikt grijpen daar dus meteen miljoenen rampjes plaats: tromboplastine wordt gevormd, maakt met protrombine van het langskomende plasma snel trombine, waardoor de ook langskomende bloedplaatjes kleverig worden en de speldeprik klonterig volproppen. Dan beginnen de beschadigde plaatjes zich hun eigen afkomst van de ontplofbare trombocyten te herinneren: uit al hun membranen parelen hele ritsen fosfolipidemicellen die de stolling van het al half gestolde plasma rondom nog meer bevorderen-maar wel een beetje laat, het weefseltromboplastine had die stolling al een minuut geleden verzorgd. Wel hadden de plaatjes wat (meest apolaire) factoren v en viii en fibrinogeen op hun oppervlak zitten, dat nu misschien nog actief vrijkomt, als mosterd na de maaltijd. Nee, vroeger, in de goeie ouwe tijd van miljoenen jaren geleden, en nu nog bij antiekere dieren dan de mens, ging dat allemaal anders. In degenkrabben bijvoorbeeld bevatten de trombocyten waarschijnlijk alle factoren die voor de stolling nodig zijn; maar degenkrabben zijn levende fossielen. In de zich meer ontwikkelende dieren begonnen steeds meer stollingsfactoren buiten de trombocyten om gevormd te worden en kwamen
in opgeloste staat in het plasma terecht. Tenslotte, door de ene mutatie na de andere, werd zelfs het systeem waarmee de trombocyten de nodige ontplofbare gevoeligheid voor aanraking hadden bereikt, overgenomen door het plasma: factoren xi en xii. Onze weefselcellen intussen werden door hun eigen mutaties beziggehouden. Het tromboplastine dat die cellen tegenwoordig nog maken heeft dan ook een andere manier om ons protrombine om te zetten dan de manier die ons plasma zelf heeft ontwikkeld: tromboplastine werkt via factor vii, plasma niet. Zo
| |
| |
werd de kans om te blijven bestaan misschien wel het best voor die diersoorten waarin mutaties het minste conflict veroorzaakten tussen de stollingssystemen van weefsel en plasma.
Want alles muteert. Zelfs de schijnbaar onveranderlijke slungel fibrinogeen ondergaat de ene mutatie na de andere. Enige kennissen van me hebben de kleine peptiden die trombine van fibrinogeen afsplitst, voor verschillende diersoorten geanalyseerd. Ze konden toen voor gewervelde dieren een grafiek maken: verticaal afzetten welk percentage aminozuur-keten van die en die diersoort nog overeenkomt met de onze, en horizontaal hoeveel miljoen jaren geleden we denken dat die diersoort op de wereld verscheen. Je krijgt dan werkelijk een scheve lijn, en als je die doortrekt tot het denkbeeldige punt ‘nul percent keten hetzelfde als van de mens’, kom je terecht in de periode van, vermoedelijk, de allereerst verschijnende gewervelde dieren. De biologische conclusie uit dat wiskundige spelletje is dat pas bij de gewervelde dieren voor het eerst peptiden van fibrinogeen werden afgesplitst gedurende het stollen. Of die conclusie werkelijk logisch is, dat kan jij mij even goed vertellen als ik jou.
Een even theoretische grafiek is door anderen gemaakt, voor het ademhalingsenzym cytochroom C, een molecuul dat een beetje op hemoglobine lijkt, maar zo algemeen bij dieren en beestjes en zo voorkomend dat we bijvoorbeeld het percentage van overeenkomst kunnen berekenen tussen gist en mens. Die curve kunnen we dus helemaal terugconstrueren naar de tijd dat gist ontstond. En hetzelfde trucje kunnen we toepassen op de korte tijd dat hemoglobine tot nu toe schijnt te bestaan. Mens en gorilla verschillen bijvoorbeeld daar maar in drie of vier aminozuren; zo weinig dat er best op dit ogenblik kerngezonde mensen en gorilla's met elkaars mutaties rond zouden kunnen lopen. Maar zo'n verandering, alleen maar in zijn hemoglobine, zal geen gorilla daarover tot nadenken brengen, en zou alleen maar laten zien hoe verwant we zijn. Tussen de verste uitersten daarentegen: mens en vis, is het verschil ongeveer compleet en hebben de hemoglobines nog maar ongeveer een enkel aminozuur gemeen. Daar moet wel een heel lange tijd tussen liggen, want met elke mutatie neemt de kans toe dat de volgende mutatie gebeurt op een plek van het verantwoordelijke dna waar al eerder een mutatie geweest is. Honderden miljoenen jaren moeten voorbij zijn gegaan tot eindelijk die ene sport van het dna waarin nog nooit een verandering was
| |
| |
geweest, door een kosmische straal of zo geraakt werd. Volgens bijzonder ruwe berekeningen verlopen er tien à twintig miljoen jaren tussen twee mutaties.
Misschien is het je opgevallen dat eigenlijk alle mutaties waar ik het tot nu toe over heb gehad, verlies betekenden. Verlies van het vermogen, voortaan een eiwitsoort te maken zo dat het precies goed in zijn oude systeem kan werken. Miljarden jaren geleden waren we nog jong en groen. Zorgeloos maakten we suiker uit lucht en water. Toen kwam Witte Woensdag: mutatie! We verloren het vermogen om chlorofyl te maken, en moesten beginnen te bewegen, om andere wezens te vangen en op te eten die nog wel groen en zoet gebleven waren. Bleek maar bezig, leerden we zo te leven met onze nieuwe ziekte.
Dat vermogen, om ons aan te passen bij elke nieuwe erfelijke ziekte die ons overviel, moeten we al hebben gehad toen we nog maar enkele proteïne- en dna-moleculen groot waren. Je weet nog wel wat er met Hb a gebeurde toen het Hb s werd: zijn moleculen begonnen zich tot lange kristalbundels opeen te pakken, alleen maar doordat hun nieuwe molecuulvorm dat verlangde. Misschien zijn we zelf ook wel zo opgegroeid in de hete, afkoelende valleien onder de oceaan, uit eiwitmoleculen die zich vasthechtten op precies de meest groeizame patronen van elektrische ladingen op gemengde rotskristallen, een kantwerk van geadsorbeerd proteïne kwekend met hydrofobe en waterstofbanden, aldoor muterend maar uit het ene na het andere ongeluk weggroeiend, intussen chaos vangend in onze mazen en daar orde van frunnikend, langsdobberende vetdruppels en fosfolipiden opsluitend en daar micellebellen van blazend die op hun beurt weer eiwit adsorbeerden en enzymen veilig in zich sloten.
Een zo'n micellebel met inhoud, die er misleidend eenvoudig uitziet, is de rode cel; en voorwaarts dus, naar het volgende hoofdstuk.
|
|