|
| |
| |
| |
II Hoe wij spelen met proteïnen
Er is iets in dat woord ‘proteïne’, bah, dat me nog steeds niet bevalt. Ik weet geloof ik wel waardoor. Ik heb altijd een hekel gehad aan de smaak en walm van gekookte vis, en ik moet op de tedere leeftijd van zeven jaar of zo een keer dat ellendige plaatje gezien hebben van een schijf in parten verdeeld, je weet wel, met op een part een fles olie, ‘vetten’ geheten, op een ander een klontje dat zich ‘koolhydraten’ durft te noemen, en op een derde een keukenbordje waarop de doodste makreel ter wereld het toch al zo moeilijke woordje ‘proteïne’ of ‘eiwitten’ tracht uit te spreken. Daar bestond een mens dan uit; en ik ook, net als ieder ander, dat was nog het ergste. Ongeveer tien jaar later kreeg ik weer proteïnen onder mijn neus, deze keer in een studentenlab waar de ondingen gekookt werden voor chemische experimenten die even dood waren als de makreel van vroeger. Weer vijftien jaar later, toen ik in New Brunswick werkte, zag ik in het laboratorium voor bloedchemie naast mijn eigen kamertje hoe proteïnen daar voornamelijk andere stoffen in de weg zaten, die pas gemeten konden worden als er eerst een zuur in het bloed kon worden gesmeten om de eiwitten in een volkomen oneetbare geschifte chocolavla te veranderen.
Maar eiwitten zijn mooi; het meeste werk ermee levert nu eenmaal niet meer op dan vormeloze statistische en on-emotionele getallen. De reis naar een ver eiland wordt niet aantrekkelijker door te leren dat daar negentien en een kwart pruiken tabak worden geproduceerd per anderhalf dorpshoofd behalve op Woemidag. Pas als je in een beter boek leest hoe bij volle maan de Woemi met een tabakspruik op een langgewimperde plukster, nou ja, ik wil maar zeggen dat ik eigenlijk ook voor mijn werk met bloedplaatjes en stolling een reis moest maken, Proteïneland in namelijk, en om die aantrekkelijker te maken kocht ik maar vast een paar dikke, lekker ruikende boeken over eiwitten; en begon te lezen.
Dat was eigenlijk een slecht begin. Een wetenschappelijk boek dat even grondig als dik wil zijn moet tegenwoordig namelijk door een hele groep mensen worden geschreven. Nou is er altijd wel een schoft die zijn hoofdstuk een of twee jaar te laat inlevert, en tegen die tijd
| |
| |
zijn de andere hoofdstukken verouderd. Daarom vertelt de publikatiedatum van een boek je niets over de ouderdom van zijn inhoud: daarvoor moetje kijken wat de jongste datum is van de publikaties die in het boek worden aangehaald. Een goed boek over eiwitten hoort in elk hoofdstuk minstens een paar artikelen aan te halen die minder dan een jaar oud zijn. (Dit boekje is geen leerboek en hoeft dus lekker niet naar dergelijke artikelen te verwijzen.)
Gelukkig begon ik toen ook chemische tijdschriften te lezen. Was ik al geschrokken door al de nieuwigheden in de paar eiwitboeken, nu blies ik belletjes van schrik onder de constante stroom van vreemde feiten die zich uit nieuwe bronnen over mijn hoofd uitstortten. En achter die feiten waren andere, nog meer fundamentele feiten verborgen; ik begon eindelijk te begrijpen dat ik meer moest leren over atoomstructuur.
| |
Het atoom dus
Het was nog vóór de tweede wereldoorlog dat ik mij voor het laatst met atomen had geamuseerd. Ze bestonden toen alleen nog maar uit elektronen, protonen en neutronen, geloof ik; tegenwoordig bestaan ze uit van alles, maar ik geloof niet dat we alle nieuw ontdekte kerndeeltjes nodig hebben om iets van de elektrische gebeurtenissen in de huid van een eiwitmolecule te begrijpen. Onthoud wel dat er protonen in de kern zitten. Elk proton geeft de kern een eenheid van positieve lading. En onthoud ook dat de elektronen, elk een eenheid van negatieve lading gevend, om de kern heen draaien. Dat doen ze niet zo maar: ze volgen banen van vaste vorm en grootte, springen alleen in tijden van grotere opwinding soms op een grotere maar even voorbestemde baan, en geven energie (licht) wanneer ze weer terugspringen. In elke baan is plaats voor een enkel paar elektronen die tegen elkaar in draaien. Groepen van die elektronenbanen vormen schalen, die van de natuurkundigen letters hebben gekregen: K, de binnenste, die maar een enkel paar kan hebben dat 1s heet; L, de schaal, om K heen, heeft plaats voor een paar(2S geheten) plus drie paren (2p); M daaromheen met een paar 3S, drie paren 3p en vijf paren 3d; en verder ga ik niet.
Het lijkt me ook goed om te onthouden dat de natuur niet houdt van ontplofbare situaties en daar soms haastig een einde aan maakt.
| |
| |
Onder minder explosieve omstandigheden betekent dat: als iets onvoldaan is, probeert de natuur daar zo gauw en zo eenvoudig mogelijk iets aan te doen. Maar als alle behoeften te bevredigen waren zonder nieuwe behoeften te verwekken, zouden alle gebeurtenissen, zoals die waar wij zelf uit bestaan, spoedig afgelopen zijn. Gelukkig dus, leeft zelfs een atoom meestal in een onbevredigde en zelfs onbevredigbare toestand. Het heeft twee behoeften waaraan het vanwege zijn rare systeem nooit tegelijk kan voldoen. De ene behoefte is elektrisch neutraal te zijn: evenveel elektronen om de kern als protonen in de kern. De andere behoefte is: alle schalen precies vol elektronen te hebben. In de tabel hier, hebben alleen helium, neon en argon (He, Ne en Ar) hun schalen vol en zijn tegelijk neutraal. Daardoor zijn ze edelgassen; ze hebben geen elektronen nodig en willen er geen kwijt; ze willen met niemand spelen of delen, ze zijn helemaal tevreden.
|
1s |
2s |
2p |
3S |
3p |
| 1 H |
1 |
|
|
|
|
| 2 He |
2 |
|
|
|
|
| 3 Li |
2 |
1 |
|
|
|
| 4 Be |
2 |
2 |
|
|
|
| 5 B |
2 |
2 |
1 |
|
|
| 6 C |
2 |
2 |
2 |
|
|
| 7 N |
2 |
2 |
3 |
|
|
| 8 O |
2 |
2 |
4 |
|
|
| 9 F |
2 |
2 |
5 |
|
|
| 10 Ne |
2 |
2 |
6 |
|
|
| 11 Na |
2 |
2 |
6 |
1 |
|
| 12 Mg |
2 |
2 |
6 |
2 |
|
| 13 Al |
2 |
2 |
6 |
2 |
1 |
| 14 Si |
2 |
2 |
6 |
2 |
2 |
| 15 P |
2 |
2 |
6 |
2 |
3 |
| 16 S |
2 |
2 |
6 |
2 |
4 |
| 17 Cl |
2 |
2 |
6 |
2 |
5 |
| 18 Ar |
2 |
2 |
6 |
2 |
6 |
| |
| |
Voor de andere kleine atomen in deze tabel (een tabel van alleen de kleinste atomen) bestaat meer avontuur in de wereld. Als ze hun schalen vol willen maken verliezen ze hun elektrisch evenwicht. Een volle L-schaal moet acht elektronen (vier paren) bevatten; maar daarmee zou bijvoorbeeld zuurstof twee extra negatieve ladingseenheden hebben. Natrium (Na) heeft twee keurig volledige schalen, K en L, en maar een enkel elektron in M. Als het atoom die opruimt blijft het met een netto positieve lading zitten. Zo'n geladen atoom (of een geladen, chemische combinatie van atomen) noemt men een ion. Het waterstof-ion (H+) is een positief ion van het waterstofatoom dat zijn enige elektron kwijt is; we kunnen het dus een naakt proton noemen. Dit kan een brug vormen tussen twee negatieve atomen: een waterstofband. Dat is geen chemische verbinding: hij wordt te gemakkelijk gemaakt en gebroken. Als daarentegen een atoom F een atoom Na ontmoet, bijvoorbeeld, dan ontstaat, zoals je uit de tabel kan zien, een combinatie die én precies volle schalen heeft gekregen én in elektrisch evenwicht is. Het stel lijkt samen waarachtig op een nieuw soort edel element; het heet nu NaF, een chemische stof met nieuwe eigenschappen, gevormd doordat het Na en het F elkaars teveel en tekort aan een elektron precies hebben aangevuld. Maar iedereen die wel eens een keer een kind geweest is, kan je vertellen dat gelijk delen-ieder precies de helft-niet goed kan. Atomen hebben dat probleem net zo goed, en het ene atoom krijgt dikwijls een grotere helft dan het andere. Als een stof even stabiel is in geïoniseerde als in ongeïoniseerde toestand, zal hij het best vinden om af te wisselen: soms de elektronen zo onder zijn atomen verdelen dat hun schalen vol zijn, soms uit elkaar gevallen lijken te zijn in tegenovergesteld geladen ionen, die elkaar dan toch wel aantrekken, en bijvoorbeeld in water niet helemaal onafhankelijk van elkaar ronddobberen.
Water is zelf trouwens helemaal niet zo eenvoudig als het klinkt en smaakt. Je bent er nu eenmaal aan gewend. Je hebt al geleerd het haa twee o te noemen voordat je eerste scheikundeles begon. Aan het eind van mijn hbs-tijd schreef ik het al H-OH. Maar toen ik verleden jaar op een conferentie was over de structuur van water, vier dagen lang, waren de specialisten het er nog niet over eens hoe water onder dagelijkse omstandigheden in elkaar zit. Wel was iedereen er zeker van dat er vaak waterstofbanden waren tussen waterstofatoom van een watermolecuul en zuurstofatoom van een ander, en zo voort. Water
| |
| |
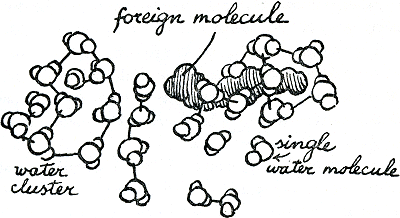
is dus soms H2-O... H-O-H... O-H2 of nog veel langer en ingewikkelder. Je kan je misschien het best een hoop V-vormige magneten voorstellen met hun zuidpolen in het midden. Je kan die natuurlijk op duizenden manieren aan elkaar laten hangen. Met water gebeurt dat soms zo regelmatig als in een kristal, waarbij het niet beslist sneeuw of ijs hoeft te worden. Vaak (om van misschien maar te zwijgen) vormt het bobbels of holle slierten (figuur 11).
Figuur 11.
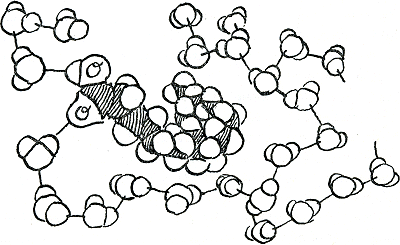
Nu moet je niet denken dat watermoleculen meer van elkaar houden dan van iets anders. Ze houden zich waarschijnlijk alleen maar in grote complexen aan elkaar vast met hun waterstofbandjes als die niets beters kunnen vinden om vast te houden. Als je bijvoorbeeld een groot hydrofoob, dus water-afwerend, onbenatbaar, molecuul het
Figuur 12.
| |
| |
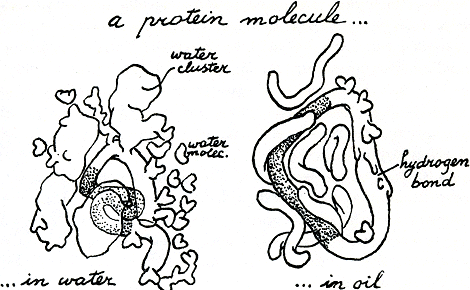
water in duwt, breek je daarmee een hoop waterstofbanden in het water eerst en dan binden de watermoleculen zich en elkaar opnieuw vast, nu op zo'n manier dat ze zo min mogelijk met dat onvriendelijke vreemde voorwerp in contact hoeven te komen (figuur 12). Het tegengestelde gebeurt met moleculen die NH2, of O, of andere groepen bevatten waaraan makkelijk waterstofbanden kunnen worden vastgemaakt. Die mengen zich graag met water; en de watermoleculen zelf delen graag hun waterstofbanden met die van deze vriendelijke, hydrofiele moleculen zodat ze daar nogal stabiele fabricages mee vormen. Als het water zich dan zo handig aan kan passen, wat zou er dan gebeuren als je twee hydrofobe moleculen tegelijk erin onder wil laten zinken? Weer probeert de natuur iedereen zo gauw en simpel mogelijk tevreden te stellen: de twee vettige moleculen houden elkaar zo gauw en stevig mogelijk vast, om hun aan het water blootgestelde oppervlak zo klein mogelijk te maken en het kleinst mogelijke aantal watermoleculen tot een demonstratie van afkerigheid te dwingen. Zulk elkaar omhelzen van twee vettige moleculen uit angst voor het omringende water is dus een ‘hydrofobe band’. Hydrofobe banden kunnen zich ook vormen tussen vetachtige onderdelen van een of twee moleculen die dan, als ook de rest van hun lichamen zacht genoeg is, de gekste standen kunnen maken van aanhankelijkheid zodra ze in water terechtkomen. In olie hoeven hun waterafwerende plekken natuurlijk niet samen te kleven en zijn dus de hydrofobe banden zwakker dan de waterstofbanden. In figuur 13 is een grappig soort molecuul getekend: het heeft een klein hydrofiel koppetje van een zuurgroep(O en OH) en een lange vettige staart van C-C-C- waaraan alles verder is aangevuld met waterstofatomen. Het geheel is een vetzuur. Probeer je eens in te denken dat je een heel stelletje daarvan in water gooit; wat doen ze dan? En wat zouden ze in olie doen? En in een mengsel van water en olie?
(Het antwoord voor de drie gevallen is: ze kleven met hun staarten aan elkaar en hun koppen naar het water; ze kleven met hun koppen naar elkaar en hun staarten naar de olie; ze vormen laagjes om oliedruppels met hun koppen naar het omringende water en om waterdruppels met hun staarten naar de olie.) Nu heb je een idee hoe detergents in staat zijn olie in fijne druppels met water te laten mengen. We hebben veel zulke detergentachtige moleculen in ons bloed. Proteïnen zijn ook een beetje zo. Je zult straks lezen dat het lange ketens zijn, die bestaan uit meer of
| |
| |
minder vettige schakels; in water frommelen ze zich dus graag zo in elkaar dat de meest hydrofobe delen verborgen zijn (figuur 13, gestippelde lus), maar daarover later.
Zo, dat zijn dus de verschillende krachten die het leven van moleculen, en van ons als hun gastheren, bepalen: de chemische die door
Figuur 13.
de vulling van elektronenbanen worden bepaald en zo sterk zijn dat de volgorde van de atomen in het molecuul er stevig door wordt bepaald, en de fysische, zoals waterstofbanden en hydrofobe banden (die zelf weer veroorzaakt worden door de waterstofbanderigheid van het water rondom), die zwakker zijn, en daarom veranderlijker naar omstandigheden, en daarom juist zo belangrijk: het zijn deze zogenaamd zwakke krachten die maken dat hetzelfde molecuul het ene ogenblik bij wijze van spreken met de armen gekruist over de borst rondhangt en het volgende ogenblik wild er op los slaat. Maar zo menselijk zijn ze natuurlijk niet, die moleculen. Als we even groot waren als zij, en als elektronen er wit uitzagen-en waarom ook niet?-hoe zou het dan zijn om rond te lopen binnen een beetje water? Wolken van stijf rechtopstaande en slap neerhangende trossen mistballonnen, dat zijn andere moleculen, maar daaromheen, die witte kooien, kronkelende torens met witte snorren, wollige witte winterjassen, en kromme puistige witte blazen, die miljoenen malen per seconde uiteenvallen en zich in andere gedaanten weer bijeenrapen, dat is water, een wat-
| |
| |
ten wereld van weerloos wisselende weke spoken. De zachtheid van een molecuul is eigenlijk maar een statistisch begrip, en je kan evengoed zeggen dat de grijze schijf van een snel draaiend fietswiel een doorzichtige massa is van 30% metaal en 70% lucht. Dat is tegelijk waar en niet. Steek je vinger er maar eens in: die dertig percent lijkt dan het belangrijkst, maar is dat toch ook eigenlijk alleen maar vanwege de snelle verandering van lucht in metaal. En zo is het ook met moleculen: hun huid is geen stille werkelijkheid maar een zachtlijkend complex van gebeurtenissen; elektronen die trillen en wentelen rondom hun eigen atomen en overspringen op andere. De kernen liggen als diepe, positieve, zware ladingen dieper in de achtergrond naarmate ze zwaarder zijn, verborgen oorzaken van het molecule. En nu terug naar de eiwitten.
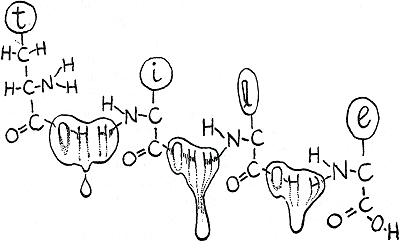
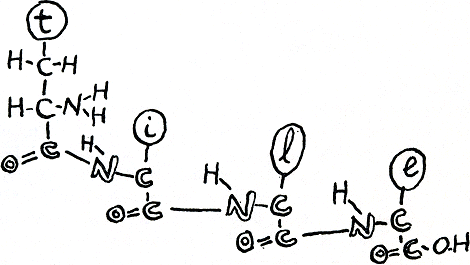
C, N, O, en H, dat zijn de kleine atomen waaruit het eiwitlichaam voornamelijk bestaat. Als je dit lichaam, tegen zijn wil in, tot een recht geval uitrekt, zou het heel lang zijn en even ingewikkeld als een met de hand geschreven geheimwoord. Een ketting van schakels die stuk voor stuk een keuze zijn uit twintig mogelijkheden. Elke schakel noemen we een aminozuur, en de tekening hieronder (figuur 14) kan je beter dan menselijke woorden laten zien hoe aminozuren samen een oneindig aantal eiwitwoorden kunnen spellen. Je ziet daar hoe de verbindingen tussen de aminozuren gevormd worden doordat de -OH van een -COOH-groep en de H- van een -NH 2-groep zich afsplitsen
Figuur 14.
| |
| |
en samen een H 2O-molecule maken. Als dat gebeurd is, kan je van het ene aminozuur naar het andere stappen, zoals van de ene geschreven letter in een woord naar de andere, bijvoorbeeld in het woord ‘tile’ (figuur 15). (‘Dit is een Engels woord, want dit boek werd eerst in het Engels geschreven. Het woord betekent toevallig tegel maar
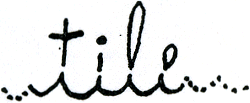
Figuur 15.
dat doet er eigenlijk niet toe. (vert.)’ heeft Tineke hier helemaal onpersoonlijk bijgezet, de snoes.)
Zo is de ruggegraat van een proteïnemolecule opgebouwd uit een rij van al de aminozuren die -N-C-C-O zeggen (figuur 16). Als je maar een paar aminozuren aan elkaar knoopt, bouw je een eiwit zo klein dat het niet eens zo mag heten, en peptide genoemd wordt (dipeptide, tri-peptide, enzovoort), maar de hoeken waar zelfs die paar aaneenschakelingen mee gemaakt moeten worden geven ook aan de kortste keten een vreemde vorm, en vaak een bijzondere en bijzonder belangrijke functie. Er zijn allerlei peptiden in ons bloed die vaatverwijdend, vernauwend of wat ook zijn. Zeer knappe mensen hebben de engte van de banden in de ruggegraat en hun toegestane hoeken be-
Figuur 16.
| |
| |
rekend. In figuur 16 bijvoorbeeld horen eigenlijk de O₌ aan de ene C en de H- aan elke N daarnaast in tegenovergestelde richting te wijzen en in één plat vlak te liggen, maar de -C- links van elke N moet het overschot van het aminozuur daaraan vast dwingen scheef uit het papier te steken. En doordat dit overschot, de aminozuurrest, juist het
Figuur 17.
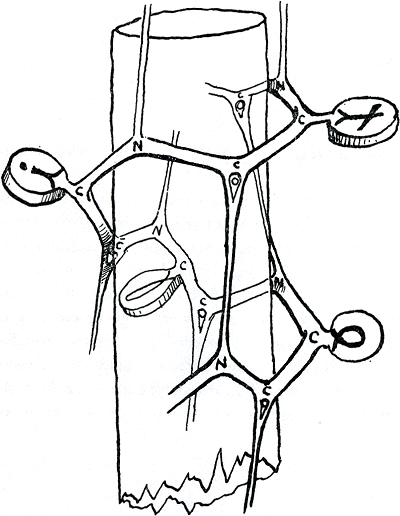
deel is waar de twintig variaties in bestaan, beginnen we alvast met een platte zigzag van een woord waarvan de letters in alle richtingen uit de pagina prikken. In werkelijkheid is het schrift veel gekker. Meestal windt de ruggegraat zich het liefst in een spiraal, zodat gedeelten van het eiwit gewonden lijken om een onzichtbare of eerlijk gezegd afwezige stok. Zo'n spiraal werd het eerst beschreven door Linus Pauling en Robert B. Corey in een mededeling die erg belangrijk bleek te worden (J. Amer. Chem. Soc, Vol. 72, P. 5349, 1950). Het stukje beslaat maar een halve pagina en beschrijft verschillende
| |
| |
vormen die op grond van berekende bandhoeken en lengtes toegestaan zijn; de spiraal (helix) is daarvan de meest elegante. Als je je namelijk de opgewonden ketting voorstelt wijzen die tegenovergesteld gerichte C₌O en N-H groepen precies naar elkaar en kunnen waterstofbanden naar elkaar toe maken die de spiraal bij elkaar houden (figuur 17).
Maar er zijn verschillende aminozuren die te onhandig dik en krom zijn om tegen deze spiraal te passen; waar ze voorkomen vervormen ze de spiraal zoals een vinger zou doen die tussen de windingen van een oude ijzeren springveer gekneld zit. En de hoek van afwijking, die zo'n hinderlijk aminozuur veroorzaakt, kan ook al weer worden berekend. Wat is er nu nog over van ons eerst zo eenvoudige geheimwoord? Eerst staken de letters al in allerlei richtingen uit het papier, toen werd het papier als een strook om een stok gewonden en nu is die stok nog overal gebogen en geknakt ook. Dragen, behalve de waterstofbanden, de hydrofobe daarvan ook nog schuld? Van de twintig aminozuren die een eiwit gebruiken kan, zijn er heel wat min of meer hydrofoob, met bijvoorbeeld een rechte of gevorkte vetstaart.

Figuur 18.
Als het eiwit waaraan die kereltjes hangen in het water wordt gegooid en een voldoend zachte ruggegraat heeft, kunnen ze zo hard proberen hun vette lijfjes bij elkaar te houden dat ze het hele proteïne dwingen zich in de raarste bochten te wringen. Men neemt aan dat hun dit werkelijk vaak lukt, zodat ze in water het eiwitmolecule helemaal kunnen buigen tot ze zelf met hun hydrofobe banden het hartje vormen van de nu tot een prop samengeknoeide springveer.
Het is, geloof ik, helemaal niet zo gek om een proteïnemolecuul een woord te noemen, of zelfs een aan elkaar geregen zin. Een waarvan de
| |
| |
betekenis ‘gewoon’ is wat er staat. Maar de moeilijkheid is: hoe lees je zo'n serie letters als ze om een stok heen gewonden zijn, en dan nog een gebogen of geknakte stok? Als je een eenvoudige chemicus bent, grijp je onmiddellijk het strookje papier en ontrolt het. Dan krijg je inderdaad alle letters op een keurig recht rijtje, en is bijvoorbeeld het

Figuur 19.
volgende te lezen (figuur 19): menufordadsbeerr (zonder ruimte tussen de woorden). Ben je meer biologisch aangelegd, dan vraag je je af: als het beestje in zijn eigen vrije natuur zo graag die opgekrulde vorm heeft, dan moet ik zijn betekenis misschien wel lezen terwijl het die houding aanneemt. Dan vind je bijvoorbeeld letters nummer 1, 4, 7, 10, 13 en 16 netjes naast elkaar, of een kronkel waarin nummers 1, 2, 3, 10 en 11 op een rij komen, of 6, 7, 8, 14 en 15.
In bloedplasma worden veel voorbeelden gevonden van activiteiten die geheimzinnig optreden en verdwijnen. Later in deze eeuw zullen de meeste wel kunnen worden uitgelegd als het open en dicht vouwen en krullen van eiwitmoleculen. Want een enzym-dat is een eiwit dat, als het actief is, een bepaalde chemische reactie miljoenen malen kan versnellen-is vaak alleen maar te herkennen aan zijn activiteit; inactief is het onvindbaar, zoals we ook later zullen zien. Enzymen zijn bijzonder specifiek. Er zijn bijvoorbeeld allerlei dehydrogenasen, enzymen die waterstofatomen wegbreken van bepaalde plaatsen in bepaalde soorten molecule; en er zijn proteasen die proteïnen (zelfs hun eigen lichamen als ze niet voorzichtig zijn) in tweeën breken maar alleen tussen twee bepaalde soorten aminozuurgroepen in de keten. Veel van die enzymen drijven rond met ons bloed in een (gelukkig) inactieve vorm en worden door bepaalde
| |
| |
omstandigheden of zelfs door bepaalde andere actief geworden enzymen geactiveerd. En zo is ons hele plasma als een heel vreemd boek dat soms hier, soms daar door de kracht van zijn eigen woorden wordt opengeslagen. Een kracht die zich alleen ontwikkelt als iets een paar verwrongen woorden tot een nieuwe betekenis vervormt. Zo'n boek is alleen te begrijpen en volledig lief te hebben uit alle open en dichte betekenissen van al zijn woorden en de betekenis van hun rangschikkingen, die zoveel wijder is als geheel dan de betekenis van woorden alleen. Met zo'n ingewikkeld complex kunnen we alleen maar proeven doen zoals kleine kinderen proeven doen met de taal van hun ouders. ‘Pas op, kindje, die vlam is heet.’ ‘Heet?’ zegt het wicht en steekt zijn vinger in de vlam. Au. ‘Nou niet bij Mammie op schoot zitten, Mammie is te heet.’ ‘Heet?’ Een vingertje in Mammie's wang. Niet au. Zelfde groep aminozuren, niet altijd zelfde graad van activiteit. Een kerel buigt zich over het wicht. ‘Ik heet mijnheer Kerelmans.’ Voorzichtig vingertje. Heet? Hij helemaal niet heet, hij koud. Zelfde groep aminozuren in ander zinsverband, andere activiteit. Zo leren kinderen en biochemici langzaam aan. Pas als ze gaan leren schrijven, dat wil zeggen pas als de biochemici leren synthetisch actieve eiwitten te maken, kunnen ze door van allerlei te proberen, precies uitvinden hoe een reeks letters van betekenis verandert met zijn omgeving; zoals een kind dat zo maar een rij letters opschrijft en dan zijn moeders gezicht bestudeert als ze die probeert te lezen. En we moeten natuurlijk ook niet vergeten te proberen eens met Moeder Natuur mee te lezen als ze haar eigen boeken schrijft of herleest: het is altijd mogelijk dat we dan een diepere kijk en een warmere verhouding winnen. In ieder geval moeten we leren hele woorden intact uit hun tekstverband te lichten en onbeschadigd in zuivere toestand in andere liefst door
ons zelf gemaakte teksten te passen om te zien wat ze daarmee doen. Met andere woorden: we moeten in ieder geval leren de al dan niet actieve proteïnen in levende toestand te isoleren, te zuiveren, en met behulp van hun eigen activiteit te bewijzen dat we werkelijk geslaagd zijn.
| |
De analyse van eiwitten
De grofste maat van verschil tussen een eiwit en het andere is zijn gewicht. Dat hangt af van aantal en grootte van alle aminozuurresten
| |
| |
die het bevat. In principe is zo'n moleculair gewicht eenvoudig genoeg te bepalen. Je zet gewoon het eiwit in een vloeistof waarvan het soortelijk gewicht bekend is, en kijkt dan hoe goed het eiwit daarin zinkt. De aantrekkingskracht van de aarde kan zulke aparte moleculen niet recht en vlug genoeg tussen de vloeistofmoleculen door laten
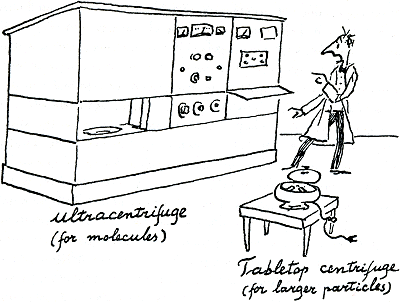
Figuur 20.
zinken; we moeten dus de oplossing centrifugeren, en zelfs met een snelheid van ongeveer veertigduizend omwentelingen per minuut. Hele bloedcellen kan je met een twintigste van die snelheid neercentrifugeren en dat kan je met een klein machientje doen (figuur 20); de ultracentrifuge, voor moleculen, beslaat een halve huiskamer om een vingerhoedje vol vloeistof rond te draaien in een klein cirkeltje. Daarbij is ook nog een heel optisch systeem nodig om te laten zien waar de vloeistof het dichtst (zwaarst) is: daar, op die hoogte, waar de concentratie van het eiwit het grootst is. Is er maar een enkele band, dan is heel misschien het eiwit vrij zuiver; zijn er meer dichte banden ontstaan, dan weet je zeker dat er moleculen in de oplossing waren van meer dan een formaat.
Soms wordt de grootte van een eiwit geraden naar de manier waarop zijn opgeloste moleculen het licht verstrooien, of naar het volume dat ze zo innemen, en soms naar het gebied dat eiwitmoleculen beslaan als een gewogen hoeveelheid ervan zich aan het oppervlak van
| |
| |
een zoutoplossing uitspreidt (zie verderop, onder ‘monomoleculaire lagen’). Maar alle resultaten hangen af van de onbekende gedaante der moleculen, en daarvan laten ze op hun best alleen dikte meten, of hoogte, of een gecompliceerde verhouding tussen de twee. Tegenwoordig kan je ook een soort plastic poeder kopen, dat in water geleiachtig wordt; elk korreltje daarvan heeft poriën die allemaal ongeveer even groot zijn, en je kan ze bestellen met poriën die bijvoorbeeld iets groter of iets kleiner zijn dan je eiwitmoleculen misschien wel zijn. De poriën in die poederdeeltjes zuigen dan precies die eiwitmoleculen uit een gemengde oplossing, die kleiner zijn dan de poriën zelf, en de grotere eiwitmoleculen blijven in oplossing.
Ook kan je proberen of je eiwit aan bepaalde oppervlakken geplakt (geadsorbeerd) wil worden. (Binnenin iets opgenomen worden heet geabsorbeerd worden.) Ik geloof, eerlijk gezegd, dat elke onopgeloste stof wel graag een of ander eiwit adsorbeert. De meeste oppervlakken zijn bedekt met een patroon van ontevreden atomen, dus met een teveel of tekort aan elektronen, en als daar een eiwitmolecuul in de buurt komt dat zacht genoeg is om zich met zijn eigen tegenovergestelde ladingen op zo'n elektrisch behangselpatroon aan te passen, kan het altijd wel een houding vinden om het oppervlak daar keurig in detail te neutraliseren. Is dat eenmaal gebeurd met een groot deel van het oppervlak, dan zijn er misschien nog kleine geladen plekken op vrij, waaraan stijvere eiwitmoleculen met een tegenovergesteld geladen puntje willen bungelen. Of als het oppervlak bestaat uit moleculen die zelfs elkaar maar zacht vasthouden en water helemaal niet, dus als het oppervlak hydrofoob is en geen trek heeft in elektrostatische of waterstofbanden, dan zullen de zachtste rondste eiwitmoleculen daar misschien graag tegen openbarsten en zich met hun vette harten door middel van hydrofobe banden tegen het vettige oppervlak aan smeren. Aan ieder soort oppervlak, in bloedplasma gestoken, kan je dus wel een opeenvolging van adsorpties, een parade van verplakkingen, verwachten.
Je kan mooi zien hoe eiwitten en andere moleculen soms gescheiden worden door een algemeen gebruikte methode, die chromatografie heet. In principe gaat dat zo: maak ergens op een of ander poreus voorwerp (dus een voorwerp met groot oppervlak) een plekje van het mengsel van stoffen die je wilt scheiden. Laat dan het voorwerp een grote hoeveelheid pure vloeistof opzuigen; laat de vloeistof lang-
| |
| |
zaam opkruipen tot voorbij de vlek van het mengsel. Je hebt zoiets vast wel eens per ongeluk gedaan, bijvoorbeeld inkt gemorst op een stuk goed en dan geprobeerd de vlek weg te krijgen door er midden op water te laten druppelen. Je kan dan zien hoe de inktkleur zich tot een ring uitspreidt, en als je zo gelukkig was om inkt te morsen die uit een mengsel van verschillende kleuren bestaat, kon je die ring zien uitgroeien tot een cirkelvormige regenboog. De verschillende kleurstoffen werden dan weliswaar meegesleurd door het zich verspreidende water, maar ieder werd daarbij gehinderd naar zijn aard door de invloed van ladingen in het goed en het water op de ladingen van de kleurstofmoleculen. Zo kruipt het front van iedere kleurstof met een eigen, typische vertraging achter het front van het voortstormende water aan. In echte chromatografie wordt vaak filtreerpapier gebruikt, en als grotere hoeveelheden eiwit gescheiden moeten worden, kan dat door een heel torentje van opgestapeld papier, dat dan later weer in stapeltjes kan worden verdeeld. Al te ingewikkelde mengsels, bijvoorbeeld de verzameling brokken die overblijft als een proteolytisch enzym een eiwit half heeft verteerd en er peptiden van heeft gemaakt,-die kunnen niet gemakkelijk door een enkele vloeistof uit elkaar worden gehaald. Er kunnen, laten we zeggen, drie peptiden in zijn die allemaal met dezelfde snelheid door water over het papier worden gesleurd, in tegenstelling tot andere peptiden in het mengsel. Hadden we daarentegen bijvoorbeeld alcohol gebruikt, dan was ieder van die drie peptiden met een andere snelheid voortgekropen, maar die zou dan weer even groot geweest zijn als van enige andere peptiden. Wat te doen? Figuur 21 laat je een echt aardige oplossing zien, die tweedimensionele papierchromatografie wordt genoemd. Verteerde eiwitten vormen daarmee zo'n ingewikkeld patroon (door het vlekje mengsel eerst te splitsen met één vloeistof,
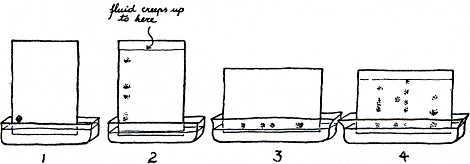
Figuur 21.
| |
| |
bijvoorbeeld water in de stappen 1 en 2, en dan alcohol in de stappen 3 en 4 daar loodrecht op), dat zo'n vel vol uiteindelijke vlekjes een ‘vingerafdruk’ wordt genoemd. Die wordt eigenlijk pas zichtbaar als je er een kleurstof voor peptiden over sproeit. Verderop in dit boek zal je zien dat zelfs de vingerafdrukken van twee eiwitten die in maar één van hun honderden aminozuurresten verschillen, ook verschillend zijn.
Als er genoeg proteïne gezuiverd moet worden om er allerlei werk mee toe te laten, wordt het vaak door een verticale buis, gevuld met poeder, gedaan. Het eiwitmengsel wordt bovenop de kolom gegoten, gevolgd door grote hoeveelheden oplosmiddel, dat dus langzaam door het poeder heen naar beneden druppelt en de eiwitten met verschillende snelheden meesleurt tot ze, de een na de ander, onderaan in het ene na het andere buisje druppelen. Dan moet je de inhoud van al die buisjes onderzoeken om zeker te weten waar je geliefde activiteit, en dus je geliefde eiwit, terechtgekomen is; want je kan met evenveel zekerheid op je eiwit wedden als op een paard in een wedren: ze zijn allemaal aan te veel onbekende invloeden onderworpen om voorspelbare snelheden te bezitten.
Een andere techniek: elektroforese, bestaat uit het scheiden van moleculen volgens hun verschillende elektrische ladingen, door hun mengsel aan een elektrisch veld bloot te stellen. De moleculen met de hoogste netto lading bewegen zich dan het snelst naar de elektrode met tegenovergestelde lading. Ook hier kan je weer de moleculen op of door een laag van iets heen laten trekken; een plak glazig stijfsel, of gelatine-achtig plastic, is populair. Of je kan elektroforese doen door een plastic strootje gevuld met zo'n gelei (figuur 22). Maar het eenvoudigst is alweer papier: filtreerpapier, nat en zoutig gemaakt om de elektrische stroom te geleiden. Een elektrode rechts, en een links, moeten het papier aanraken, en je te onderzoeken mengsel moet daar tussen in worden geschilderd als een streepje of vlekje: - | +. Als alles goed gaat wordt dat streepje dan na een paar uur meer en meer gesplitst in een rij kopieën van zichzelf, theoretisch één kopie per soort eiwit:- ||||| +, -zou je tenminste hopen.
Maar met plasma gaat nooit alles goed. Er zijn zoveel eiwitten in dat het beeld, gesplitst in de duizenden overeenkomstige strepen, wel belachelijk scherp zou moeten zijn om te kunnen zien dat je niet met een egaal uitgesmeerde band te doen hebt. Gelukkig dus, en eerlijk
| |
| |
gezegd tot mijn voortdurende verbazing, schijnen de netto ladingen van onze plasma-eiwitten in groepen voor te komen, zodat het elektroforese-patroon van plasma een rij meer of minder dikke banden vertoont, zelfs als het met papier wordt gemaakt en dan nogal vaag is. Op die manier kan zelfs een gewoon hospitaal-lab je serum-eiwitten
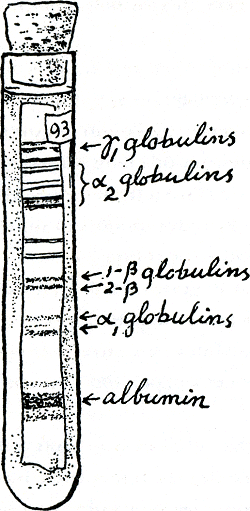
Figuur 22. Reageerbuisje waarin plastic geleistaafje met elektroforese-patroon wordt bewaard. Serum was aan een uiteinde van het staafje aangebracht in een speciaal toestel; een elektrisch veld duwde de verschillende eiwitsoorten met verschillende snelheid door de gelei. Na kleuring zag het er werkelijk zo uit als je hier ziet. Merk svp. dat in dit goedje de eiwitten niet in alfabetische volgorde bewogen.
scheiden in albuminen (eiwitten die in zuiver water kunnen oplossen) en globulinen (die zout in het water nodig hebben om op te lossen), en de globulinen weer in alfa, bèta, en gamma; en de alfa weer in alfa-een en alfa-twee, de bèta in bèta-een en bèta-twee. Maar toch kan je met zo'n enkele waarde als de totale netto elektrische lading die deze afsplitsing mogelijk maakt, niets meer opmaken of uitleggen over een eiwit dan met je lichaamstemperatuur of huidkleur over jezelf. De werkelijk intieme verschillen moeten gevonden worden in de manier waarop zo'n waarde over het lichaam is verdeeld. Trouwens,
| |
| |
van verdeling gesproken, om te zien waar de eiwitten op het papier terecht zijn gekomen moet je ze eerst nog zichtbaar maken met een kleurstof, waarvan ze doodgaan. Als je ze levend wil oogsten, moet je dus bijvoorbeeld het papier overlangs doorknippen, dan de ene helft kleuren, en dan de ongekleurde helft aan de hand van de gekleurde, in de vermoedelijk juiste zones dwars doorknippen en uit het gewenste stuk het bedoelde eiwit wassen en opvangen.
Er zijn veel manieren van zuivering die ouder, grover en saaier zijn, maar ook nog wel nuttig. Methodes vooral die berusten op temperatuur, zuurgraad, of ionenconcentratie waarbij bepaalde eiwitten gedenatureerd (uiteengewonden en onoplosbaar gemaakt) worden. Een verzadigde oplossing van ammoniumsulfaat wordt vaak gebruikt. Je giet een afgemeten hoeveelheid daarvan langzaam en al roerend bij een afgemeten hoeveelheid plasma. Allerlei eiwitten beginnen neer te slaan. Stel dat je ophoudt met bijgieten als de verhouding sulfaat: plasma 1:3 is. Het neerslag is dan van de proteïnen die ‘onoplosbaar in 25% verzadigd ammoniumsulfaat’ zijn. Je kan ze centrifugeren, de vloeistof afgieten en vervangen door een gezondere zoutoplossing, waarin de neerslachtige eiwitten weer oplossen. Daar is dan nog heel wat onbedoeld sulfaat in over, en dat moet je verliezen door dialyse. Dat gaat ook al eenvoudig: doe de zoutige massa in een zakje van cellofaan (worstvel is daarvoor populair) en hang dat stevig dichtgeknoopt in een roerig bad van de lage, gewenste zoutconcentratie. De kleine ammonium- en sulfaationen wandelen dan makkelijk door de cellofaanwand heen naar buiten, en ook heel wat watermoleculen naar binnen, maar de eiwitmoleculen, die daarvoor veel te groot zijn, blijven gevangen zitten.
Om eiwitten uit het plasma te zuiveren volgt een echt biochemisch lab bijna alle stappen die ik hierboven beschreef, en soms elke stap enige malen. De instructies voor volgelingen die dan worden gepubliceerd, zijn meestal angstaanjagend: ‘sla neer met half-verzadigd ammoniumsulfaat, los op in buffer, sla weer neer en los weer op, dialyseer tegen 0,9% NaCl, adsorbeer op bariumsulfaat, was poeder acht maal, los geadsobeerd eiwit op in 7% NaCl, dialyseer, doe chromatografie op deae, verzamel fractie in derde proteïnepiek waar activiteit moet zijn, doe daarmee elektroforese in stijfselblok; snij daaruit de tweede band van rechts.’ En natuurlijk een berg details die ik weglaat. Het afgrijselijk einde is dan nog zoiets als: ‘moet zich in ultracen-
| |
| |
trifuge als een enkel bestanddeel gedragen; moleculair gewicht moet ongeveer 42,000 zijn, met N eindstandig aminozuur glycine, C eindstandig aminozuur alanine.’ Dat eiwit is daarmee nog maar net zo goed omschreven als een zin waarvan eerste en laatste woord en totale lengte gegeven worden. Als het eiwit een enzym is, dan kan zijn functie tenminste een deel van zijn definitie zijn, samen met de opeenvolgende stappen in zijn zuivering: ‘Pingpongase, een eiwit dat pingpongballen oplost in water van een neutrale zuurgraad, en dat wordt neergeslagen door halfverzadigd etcetera, geadsorbeerd door etcetera, en waarvan de eindstandige aminozuren etcetera zijn.’ Je kan ook nog je eiwit in een dure machine stoppen die automatisch registreert hoeveel van elk aminozuur erin te vinden is. Dan is de zin dus omschreven door het aantal aaas en ooos erin, nog een vrij zinloze chemie.
Als het om een min of meer herkennen gaat, dan is er ook nog een profiel van het eiwit te vinden dat het bijna zo scherp en persoonlijk werpen kan als jij je eigen schaduw. Dat heet: absorptiespectrum. Een eiwitoplossing heeft een nauwelijks zichtbare maar individuele kleur: is verschillend doorlaatbaar voor licht van verschillende golflengten. Dat kan gemeten worden; een goede spectrofotometer (die ongeveer zoveel kost als vijf nieuwe auto's) schrijft zelfs het verschil op tussen hoeveelheid licht die je eiwitoplossing doorlaat vergeleken met hoeveelheid die zuiver oplosmiddel doorlaat, in een grafiek afgezet tegen alle golflengtes waarvoor de bepalingen gelden. Zo maakt het ding een grafiek; een twee maal zo duur toestel kan dat ook nog extra snel, en kan je laten zien of er iets in de eiwitmoleculen aan het veranderen is: de grafiek verandert op bepaalde plaatsen van vorm. Waarom? Waarom is de hoeveelheid licht van, laten we zeggen, golflengte a, of laten we liever zeggen frequentie a, voor een bepaalde typische hoeveelheid geabsorbeerd door dat eiwit? Omdat alle atomen in alle moleculen een beetje bibberen en slingeren. Misschien weet je nog dat ik je vroeg, watermoleculen te zien als V-vormige magneten. Nu moet je je daarbij ook nog voorstellen dat zo'n magneet veerkrachtig is, want de twee waterstofatomen daarin bibberen naar en van elkaar zowel als naar en van het zuurstofatoom. Stel je nu een eiwitmolecule voor: daarin alle atomen door iets als springveren of desnoods pianosnaren met elkaar verbonden en aangestoten door nogal veerkrachtige andere moleculen, en daardoor het hele gevaarte,
| |
| |
in zijn geheel rondwiegend of langzaam tollend als een mobile waaraan alle onderdelen op verschillende toonhoogten hangen te zoemen en te brommen, achach wat een oorverdovend en raar beeld heb ik daar nou voor mijn snaarinstrument in de ruimte hangen. Bovendien hoor ik daarmee uit te leggen hoe het ding trillingen absorbeert, in
Figuur 23.
plaats van uitzendt. Nou dan: als klein jongetje was ik gek op onze piano maar werd lam van verveling als ik er gewoon op moest studeren. Een van de weinige dingen die ik er uitmuntend mee kon doen was: met één voet op de pedaal staand, en zo de demping van alle snaren opheffend, het deksel bovenop openmaken, mijn hoofd diep in de gapende holte steken, er een flinke schreeuw in geven en dan luisteren. Helemaal door het eeuwige duister van muf metaal daarbinnen heen, hoorde ik dan de echo van mijn kleurloze gil aan scherven breken in een schitterend spectrum van zuivere noten, doordat iedere snaar die zijn eigen frequentie in mijn stem herkend had, meetrilde, in resonantie. De energie die de piano nodig had om zo mee te trillen kon natuurlijk maar van één bron afkomstig zijn: mijn eigen stem. De piano moest die energie geabsorbeerd hebben. Hoewel een molecuul niet in alle onderdelen verwarrend veel op een piano lijkt, kan je toch wel zeggen dat het uit een mengsel van trillingen (wit of ander gemengd licht) die frequenties (kleuren) absorbeert waarmee zijn
| |
| |
‘snaren’ (atomen en atoomgroepen) kunnen resoneren. Het molecuul haalt dus die frequenties uit het invallende licht en laat de rest door, en de spectrofotometer meet dat. Geen wonder dat er een ingewikkelde grafiek uitkomt, echt zo typisch als de scherpe schaduw, door een vreemdeling geworpen; herkenbaar genoeg om een naam te geven zonder te begrijpen.
Meer indringend en ook leuker is het volgende. Enzymen kunnen vergiftigd worden door andere moleculen. Als zo'n vergiftig soort molecuul maar klein is, kan het toch een heel enzymmolecuul verlammen door zich precies op of vlak naast de meest actieve essentiële plek van het enzym vast te klampen. Daarom is het belangrijk uit te vinden waar ergens op het vergiftigde proteïnemolecuul het vergift zit: dan weet je ook waar de activiteit heeft gezeten. Maak dus zo'n vergif, maar bouw het gedeeltelijk uit radioactieve atomen; vergiftig er dan je enzym mee; breek het stuiptrekkend enzym af tot peptiden en scheid die van elkaar, bijvoorbeeld door papierchromatografie. Laat het papier drogen en pers deze ‘vingerafdruk’ tegen een onontwikkelde onbelichte film (een groot vel zoals voor röntgenfoto's gebruikt wordt); bewaar het geheel enige dagen in het donker; ontwikkel. De enkele plek die zwart is geworden komt dan overeen met een enkel, namelijk radioactief, peptide op het papier. In dat peptide moet de essentiële activiteit van het eiwit geweest zijn. Maar je moet vooral niet schrikken als je twee of drie zwarte plekken vindt, en na een jaar werken ontdekt dat ze alle drie dezelfde serie aminozuren zijn en dus identiek. Dat zou dan komen doordat het peptide, toen het nog in het eiwitmolecuul woonde, daardoor gedwongen was tot een bepaalde houding; maar toen het eenmaal was afgehakt kreeg het meer vrijheid om de vormen aan te nemen waar het altijd van had gedroomd, en de twee of drie soorten krul die het dan verkiest zullen naar hun aard op de krachten van je chromatografie-proces reageren.
Dan bestaat er tenslotte nog een bijzonder elegante, moeilijke maar bevredigende methode, waarin de dichtheid van het proteïne-molecuul door het verstrooien van er opvallende röngtenstralen wordt afgetast. Het omwerken van de duizenden kleine en grote stippels in stapels van fotografische platen is zo ingewikkeld dat ik beslist van plan ben het nergens te beschrijven of zelfs maar te begrijpen, maar uitmuntende artikelen in de Scientific American geven een schijn van duidelijkheid waaraan niemand zich behoort te onttrekken.
| |
| |
Kortom: toen de methode op zuivere hemoglobine werd toegepast, en werkelijk de hele gedaante van het molecuul in drie dimensies voor de dag kwam, bleek het waarachtig net zoals verwacht was, gedeeltelijk op een springveer te lijken, geknakt waar precies de juiste aminozuren een knak moesten veroorzaken, en het geheel zo gekronkeld dat de meest hydrofobe aminozuren zo veel mogelijk binnen in het kluwen woonden, zover mogelijk van het omringend water af. Ook heeft het molecuul een nogal apart stuk dat niet eens op een eiwit lijkt en dat een bijzondere (ademhaling)functie heeft. Uit de röntgenpatroonconstructie bleek dit deel als een dikke rode schijf scheef uit het vette hart van de hemoglobine naar buiten te steken. Waarom nou juist zo? En het molecuul verandert een beetje van vorm als het zuurstof opneemt of afgeeft, ergens bij die rode schijf. Waarom beweegt het dan zo alsof het hijgt? Helpt dat? En dan nog wat: je kan allerlei hydrofiele aminozuren in het hemoglobinelichaam vervangen door andere hydrofiele aminozuren, en allerlei hydrofobe door andere hydrofobe, en nog kan het molecuul werken. Maar vervang vooral geen hydrofiel aminozuur door een hydrofoob: dan moet de hele vorm veranderen. Een patiënt die zo'n verandering geërfd heeft, is ziek, zijn hemoglobine gedraagt zich soms allergekst. Het lijkt dus wel of de vorm van dit eiwit zijn functie bepaalt, en niet speciaal elke aminozuurschakel. Alsof een dingetje van dezelfde grootte, uit ander materiaal gemaakt maar in dezelfde gedaante, net zo goed zou kunnen werken. Als je er op de goede plek maar dat rode schijfje in sterkt. Als je het modelletje, uit een of andere polymeer, nauwkeurig gebouwd had, zou dat schijfje er trouwens vanzelf goed in moeten glippen, en zip, daar heb je je kunstmatig hemoglobinemolecuul, ademend en wel. Er bestaat werkelijk zoiets in de natuur: myoglobine, een eiwit dat de vorm van hemoglobine heeft maar dat uit helemaal andere aminozuren is opgebouwd,
en toch ‘ademt’.
Soms heb je het gevoel dat iets met iets anders samenhangt zonder een idee te hebben waarom, en de behoefte om ze toch maar naast elkaar te zetten. Toen ik schreef over die hemoglobine-vorm versus samenstelling, moest ik mij herinneren (en ik zet dat hier dus ook maar) dat onder ‘lagere’ diergroepen hier en daar enkele soorten voorkomen die geleerd hebben hemoglobine te maken; een in modder levende worm bijvoorbeeld. Misschien is de gedaante van hemoglobine zo natuurlijk dat hij makkelijk zo maar ontstaat; misschien
| |
| |
worden de miljoenen toevallig door mutaties geknede kronkels en krakelingen door gewone natuurkundewetten gezeefd en dan bevroren in de harde clichés van de erfelijkheid; en misschien is het beest waarin door een kleine vergissing plotseling zo'n regen van rode moleculen te voorschijn bloost, zo verrijkt door zijn nieuwe zuurstof opzuigende kracht, dat het kan blijven leven zelfs als het wegkruipt in verstikkende modder, veilig verborgen voor de kaken van zijn vijanden en het gelach van zijn vrienden. Zo gaat het.
We kunnen tegenwoordig net zowat beginnen ons af te vragen hoe betekenis en geschiedenis van het hemoglobine-molecule vervlochten zijn met zijn vorm, omdat we nu pas weten hoe die vorm ongeveer is; van bijna alle andere eiwitstructuren in ons lichaam weten we nog zo weinig, dat we onmogelijk kunnen zeggen wanneer of waar de gedaante een functie heeft, en waar de volgorde van aminozuren, de spelling van de letters over de huid van die gedaante, de ware betekenis is. We kunnen niet eens raden hoeveel soorten moleculen er in ons ronddrijven zonder enige betekenis. Hoe staat het bijvoorbeeld met die Hageman-factor? Dat eiwit dat zo nodig is voor het stollen van bloed in een glazen buisje? Er moeten heel wat kerngezonde mensen rondspringen die dit fundamentele enzym missen en er nooit iets van zullen merken. Is dat hele molecuul dan voor degenen die het wel hebben alleen maar een nutteloos souvenir? Even nutteloos als de ontdekking ervan, die immers berustte op een nutteloos, kunstmatig effect van glas? We kunnen zonder glas even goed leven als zonder Hageman-factor. Hoe is het trouwens met zoveel tierelantijntjes van zoveel enzymen: zijn die heus allemaal nodig als het werkzame plekje van een enzym maar zo klein is? Is hemoglobine misschien uitzonderlijk gevoelig voor vormverwringing, en is het mogelijk dat tweederde van ons lichaam uit nutteloze submoleculaire versieringen bestaat, een berg oude kant die we meesleuren als herinnering aan de vergane miljoenen jaren? Hoe meer we over eiwitten te weten komen, des te duidelijker zien we hoe ze ons telkens weer bedriegen. Het volgende hoofdstuk beschrijft dan ook hoe normale eiwitten met ons spelen in het laboratorium, en hoe sommige abnormale eiwitten spelen met de levende lichamen waarin ze wonen.
|
|