|
| |
| |
| |
12 De scheikundige theorieën
Brigitte Van Tiggelen
‘De onstandvastigheid van de theorieën schrikt ons niet af. We zullen ze zonder spijt kunnen aanpassen wanneer een nieuwe ontdekking ons daar de noodzaak van zal aantonen. In de wijziging die de scheikundige theorieën ondergaan, zullen we geen teken van zwakte zien; we zullen er integendeel een uiting van het leven in vinden; een inductieve wetenschap waarvan de theorieën niet meer veranderen is een stagnerende wetenschap. We zullen zo aantonen dat de scheikunde een wetenschap is die door haar grootse aspiraties en nobele inzichten niet onderdoet voor andere [wetenschappen], en dat integendeel, als men ze wil beoordelen op basis van haar bijdrage tot de natuurfilosofie in verleden en toekomst, ze de eerste plaats deelt met haar oudere zuster, de natuurkunde’ (Walthère Spring, Des méthodes scientifiques et de la signification des théories dans les sciences inductives, 1877).
De 19de eeuw was ontegensprekelijk de eeuw van de triomferende chemie, een défilé van knappe concepten en theorieën. Voor het eerst leken ze te beantwoorden aan het doel van een wetenschap die nastreeft de materie te ontcijferen en de omzettingsmechanismen te begrijpen. Een waarheidsgetrouwe reconstructie van de ideeëngeschiedenis volstaat echter niet om uit te leggen waarom de chemie zo'n bijzondere plaats kreeg in de cultuur en de samenleving van die tijd. De ongelooflijke ontwikkeling van allerlei toepassingen sprak nog meer tot de verbeelding van de tijdgenoten dan de vaak opmerkelijke theoretische vooruitgang. Het dagelijkse leven veranderde geleidelijk onder invloed van de chemische industrie. Op de grens van geneeskunde en levenswetenschappen begonnen chemici de raadsels van het leven te ontcijferen, wat leidde tot een medische revolutie. De scheikundige, die zijn nut bewees in tal van domeinen, verwierf een status in de samenleving en organiseerde een nieuwe beroepsgroep. De chemici waren de eerste wetenschappers die het gebruik van gespecialiseerde geleerde tijdschriften aanmoedigden en congressen organiseerden om op de hoogte te blijven van de toestand in hun vakgebied.
De opbloei van de chemie is een internationaal fenomeen dat niettemin vaak wordt gezien als een verwezenlijking uitgaande van drie grote centra:

Chemische producten uit de laboratoria van de Gentse universiteit. 1916-1918. Gent, Museum voor de Geschiedenis van de Wetenschappen ▪
| |
| |
eerst Frankrijk, dat begin 19de eeuw voortbouwde op de erfenis van Lavoisier; vervolgens Engeland, waar de sociaal-economische structuren de ontwikkeling van een nieuw beroep en een nieuwe industrie bevorderden; tot slot Duitsland, dat het einde van de eeuw zowel industrieel als wetenschappelijk domineerde. De andere landen lagen in de nabije of verre periferie. Ze worden beschouwd als ontvangers van nieuwe ideeën die in de centra ontstonden. De taak van de historicus lijkt zich voor de perifere landen te beperken tot het bestuderen van de verspreiding, en meer bepaald tot het aanwijzen van de obstakels of aarzelingen tijdens de assimilatie. Men zoekt in deze landen ijverig naar de pioniers van een fundamentele theorie, wat andere chemici die toch degelijk werk leverden en goed onderwijs gaven, in de schaduw stelt. Bovendien gaat zo het inzicht in de diepere motivatie van de beroemde voorloper verloren. Aan België, omringd door de historisch belangrijke centra en vooral interessant als doorgeefluik, schenken historici uiteraard niet meer aandacht dan aan landen van tweede of derde rang. Een gedetailleerde herschrijving van de geschiedenis van de chemie in België past echter niet in het kader van deze bijdrage. De volgende pagina's willen vooral een aangename verkenning zijn buiten de gekende paden, waarbij her en der onverwachte gezichtspunten opduiken die de geschiedenis van de Belgische chemici nauwer kan doen aansluiten bij de ‘grote’ geschiedenis van de chemie.
| |
▪ De erfenis van Lavoisier en de dualistische theorieën van de materie: Jean-Baptiste Van Mons en Martin Martens
Eind 18de eeuw verdedigden Antoine-Laurent de Lavoisier (1743-1794) en zijn entourage een aantal nieuwe ideeën die het inzicht in de chemische verschijnselen totaal veranderden. Op het vlak van de experimentele methode, de demonstratie en de bewijsvoering bracht het systematisch gebruik van de gewichtsbalans een definitieve omkeer teweeg. Ze leverde het bewijs van de nieuwe ideeën. Het onderscheid tussen elementen en samengestelde stoffen, en de op dit onderscheid gebaseerde nomenclatuur zijn nog altijd een integraal onderdeel van de chemische wetenschap. Ook het onderscheid tussen de drie aggregatietoestanden van de materie - vast, vloeibaar en gasvormig - wordt met uitzondering van het begrip ‘calorique’, de materialisatie van vuur en warmte, nog steeds op de schoolbanken aangeleerd. Daarentegen werd de zuurtheorie van Lavoisier, die stelde dat de aanwezigheid van zuurstof in een verbinding van elementen de zure eigenschappen van deze verbinding veroorzaakte, al snel ontkracht. Lavoisier was nog in leven toen zijn collega Claude-Louis Berthollet (1748-1822) aantoonde dat blauwzuur geen zuurstof bevatte. De ontdekking van chloor en vervolgens van de andere halogenen ontnam zuurstof definitief de geprivilegieerde rol onder de elementen. Dat is niet zo verbazend als men weet dat Lavoisier bij het bedenken van de benaming ‘principe oxigine’ in 1772 impliciet steunde op de princiepentheorie van Georg Ernst Stahl (1660-1734), die de chemische (en fysische) eigenschappen verklaarde door de aanwezigheid van princiepen in de substanties. Om de te complexe wetenschap van de materie te vereenvoudigen, trachtte de chemicus deze princiepen te identificeren en te isoleren, en vervolgens de verbindingen en acties tijdens de verschillende waargenomen reacties te verklaren.
De affiniteit is een nochtans essentieel onderdeel van de laat-18de-eeuwse scheikunde dat Lavoisier bewust heeft weggelaten uit zijn discours, ondanks de oprechte overtuiging dat dit probleem een centrale plaats inneemt in de chemie. Iedereen die al was het maar van ver beïnvloed werd door Lavoisier heeft op een of andere manier het raadsel van de chemische affiniteit willen oplossen. De chemici in ons land waren geen uitzondering. Laten we Karel van Bochaute (1732-1793), die geen wetenschappelijke navolgers had, even buiten beschouwing, dan was Jean-Baptiste Van Mons (1765-1842) de belangrijkste erfgenaam van Lavoisier. Zijn biografen besteden gewoonlijk veel aandacht aan zijn rol in de verspreiding en verdediging van de anti-flogistontheorieën; zijn andere ideeën vond men echter een opvolger van Lavoisier onwaardig en werden dus vaak onderbelicht. Zo vergeet men dat
| |
| |
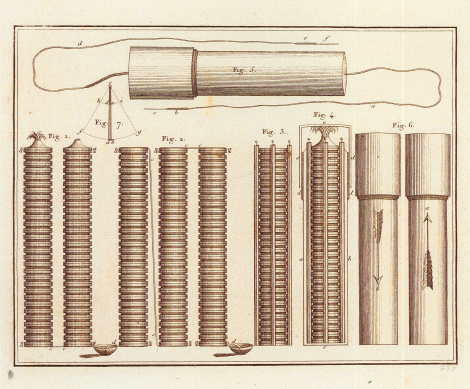
De zuil van Volta. Illustratie bij het artikel ‘Description de la pile électrique; par Alexandre Volta, ..., communiquée par Brugnatelli.’ In: Journal de chimie et de physique, I, an X, uitgegeven door Jean-Baptiste Van Mons. Brussel, Koninklijke Bibliotheek Albert I ▪
Van Mons zich baseerde op een conceptueel erfgoed dat in gevaar kwam door de ontdekking van de waterstofzuren en vooral sedert de interferentie tussen chemie en elektriciteit in het werk van Alessandro Volta (1745-1827). Waterstof nam de centrale rol van zuurstof over en verwierf de status van oerstof die voor verscheidenheid onder de elementen zorgde. Het raadsel van de affiniteit leek opgelost door de fundamentele equivalentie tussen de chemische, elektrische en magnetische krachten (zie artikel M. Bougard).
Een verklaring van chemische reacties door elektrische krachten was reeds voorgesteld op het einde van de 18de eeuw. De uitvinding van de elektrische zuil en de toepassing ervan in de chemie, onder meer voor het isoleren van nieuwe elementen, zou deze theoretische speculaties verder stimuleren. De dualistische opvatting van de materie had aan de basis gestaan van het chemisch systeem van Lavoisier: verzuurbare radicalen in combinatie met zuurstof brengen min of meer sterke zuren voort al naargelang de hoeveelheid gecombineerde zuurstof, en deze laatste produceren zouten als ze in contact komen met alkaliën (basen).
De Zweedse chemicus Jöns Jacob Berzelius (1779-1848) bedacht een dualistisch systeem dat verder ging dan de zuurtheorie van Lavoisier, die sterk in twijfel werd getrokken na de ontdekking van de waterstofzuren door Humphrey Davy (1778-1829). In zijn elektrochemische theorie van de verbinding wordt de chemische reactiviteit verklaard door de lading of de elektrische polariteit die eigen is aan elk element. Hoe negatiever een element is geladen, hoe sterker het door een positief geladen element zal worden aangetrokken. Door de elementen te rangschikken op een schaal die varieert van het meest elektropositief naar het meest elektronegatief element, werd het mogelijk de chemische reacties te voorspellen. Volgens deze dualistische opvatting van de materie is elke chemische verbinding,
| |
| |
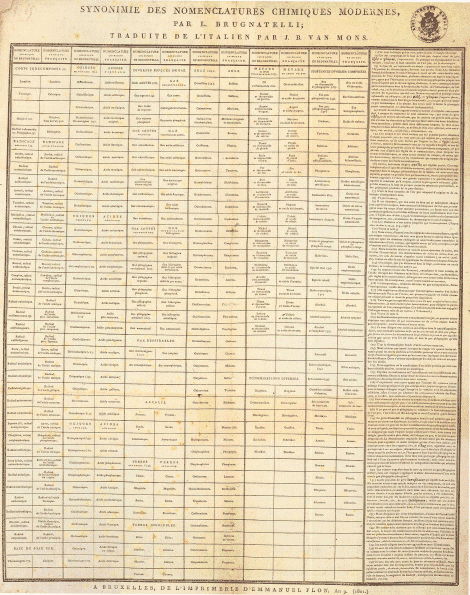
Synonymie des nomenclatures chimiques modernes, bijlage bij ‘Tableau des nomenclatures chimiques modernes’ van L. Brugnatelli, gepubliceerd in Journal de chimie et de physique, II. an X, van Jean-Baptiste Van Mons. Brussel, Koninklijke Bibliotheek Albert I ▪
| |
| |
hoe complex ook, samengesteld uit een elektronegatief element of een elektronegatieve groep elementen, verbonden met een elektropositief element of een elektropositieve groep elementen. Met zijn uitbreiding van het dualisme van Lavoisier nam Berzelius tegelijk ook diens streven over naar een betere notatie en symbolische schrijfwijze.
De elektrochemische theorie kreeg heel wat kritiek, ondanks het gezag van Berzelius en de onbetwistbare aantrekkelijkheid van zijn verklaring van de chemische reactie die nu nog steeds gedeeltelijk wordt onderwezen. Om Berzelius' systeem te ondersteunen had Adrien-Marie Ampère (1775-1836) een indeling uitgedacht van de intrinsieke elektriciteit die voor elk element kenmerkend is. De Belg Martin Martens (1797-1863) daarentegen wantrouwde theoretische speculaties; volgens hem deed de niet te ontkennen aanwezigheid van elektrische krachten in chemische verschijnselen het oude begrip van affiniteit niet noodzakelijk teniet. In zijn Réflexions sur la théorie électro-chimique de l'affinité schrijft hij: ‘De chemische verbindingen moeten hoofdzakelijk worden herleid tot de moleculaire aantrekking die wordt uitgeoefend tussen stoffen van verschillende aard’. En: ‘De elektrische aantrekking die optreedt tussen heterogene lichamen draagt bij tot het bepalen van hun verbinding en bevordert zo de affiniteit, die zonder die aantrekking vaak niet in staat is om de verbinding tot stand te brengen’. De affiniteit valt dus niet te reduceren tot de elektriciteit, ook al bevordert of verhindert deze laatste de effectiviteit van de affiniteit, net zoals temperatuur of druk, als een externe parameter van het chemisch verschijnsel. Martens besluit dat ‘men in de natuurwetenschappen nooit te snel ingewikkelde hypothesen mag verkondigen ter verklaring van de verschijnselen, hoe vernuftig ze ook lijken. Door dit beginsel te verwerpen, zijn al vaak zware fouten gemaakt, die des te funester blijken hoe meer ze terug te voeren zijn tot de basisbeginselen van de Wetenschap, en ze, bij gebrek aan verder onderzoek, uiteindelijk blindelings worden aangenomen als bewezen waarheden, zonder dat de juistheid van de redeneringen waarop ze steunen ook maar enigszins in twijfel wordt getrokken’. Hoewel deze
bedenkingen in hoofdzaak onder de vorm van een compacte redenering werden uiteengezet, steunde Martens ook op de experimentele praktijk die hem de grenzen toonde die aan de theoretische speculatie moesten worden gesteld. In zijn verhandeling Sur les radicaux multiples ou composés dans leur rapport avec la théorie des types komen zijn ideeën nog beter naar voor. Hij beklemtoont dat men moet aanvaarden dat er twee bindingstheorieën naast elkaar bestaan, elk met een eigen toepassingsveld - de elektrochemie is valabel voor stoffen die kunnen worden ontbonden door de zuil, terwijl de organische verbindingen, ongevoelig voor de werking van het elektrisch veld, onder de typentheorie vallen.
| |
▪ De gewichtswetten en de atoomgewichten: Jean-Servais Stas
Van in het begin van de moderne tijden waren de chemici ervan overtuigd dat chemische reacties plaatsvonden ‘ad minima’, d.w.z. dat er een minimale hoeveelheid materie bestaat op een voor het oog onzichtbare schaal die in staat is tot chemische interactie. Eind 18de eeuw en begin 19de eeuw formaliseerden de chemici de gewichtswetten en

Balans van Jean-Servais Stas. Brussel, Universitié libre de Bruxelles. Faculté des Sciences ▪
| |
| |
bepaalden zij de onderlinge verhoudingen van de reagentia bij de vorming van een bepaalde verbinding. Na de formulering en assimilatie van het principe van het behoud van materie, de gewichtswet, de empirische wet van de vaste verhoudingen en de wet van de multipele verhoudingen, was de chemie klaar voor de ontwikkeling van de atoomleer van John Dalton (1766-1844). Berzelius nam de theorie snel over en introduceerde ze in zijn verhandelingen.
Volgens de hypothese van Dalton bestaat de materie uit uiterst kleine ondeelbare deeltjes. De verscheidenheid van de elementen, d.w.z. de stoffen die de chemicus niet verder kan ontbinden in verschillende bestanddelen, weerspiegelt de verscheidenheid van deze atomen. Ze zijn verschillend in massa en eigenschappen. Wanneer atomen zich met elkaar verbinden, vormen zij moleculen. Dat gebeurt via enkelvoudige verbindingen die men kan uitdrukken in de vorm van een formule van b.v. het type AB of ABB. Dit geeft meteen een verklaring van de wet van de vaste of constante verhoudingen die stelt dat voor iedere component een vaste verhouding bestaat tussen het gewicht van de bestanddelen (hier A en B). Dezelfde formule houdt ook rekening met de experimentele wet van de multipele verhoudingen, d.w.z. dat met een constant gewicht van één van de bestanddelen een gewichtsvariatie van het ander bestanddeel overeenkomt volgens verhoudingen die worden uitgedrukt in gehele getallen. Aan elk atoom wordt een relatief gewicht toegekend dat proefondervindelijk wordt gevonden door bepaling van de gewichtsverhoudingen tussen de elementen die de verbindingen vormen. Voor de ‘equivalentisten’ vormen de getallen die zo uit de chemische analyse zijn afgeleid een onbetwistbare maar zuiver experimentele realiteit; voor de atomisten daarentegen zijn deze gewichten toe te schrijven aan het ondeelbare deeltje en worden ze aangeduid met de benaming atoomgewichten. Om deze relatieve gewichten te bepalen moet men vertrekken van een arbitraire basis. Vaak neemt men waterstof, waarvan het atoomgewicht wordt gelijkgesteld met 1, of zuurstof, dat wordt gelijkgesteld met 16 of 100. De bepaling van deze relatieve gewichten was dus gemakkelijk aan fouten onderhevig. Hoe nauwkeuriger men de atoomgewichten trachtte te bepalen, hoe moeilijker het werd deze fouten te vermijden.
In deze context ontstond de hypothese van William Prout (1785-1850), die stelde dat de verschillende atomen van de elementen werden voortgebracht door de condensatie van de atomen van waterstof, de oermaterie. Deze hypothese steunde onder meer op het feit dat de meeste van de toen reeds bepaalde atoomgewichten veelvouden leken te zijn van het atoomgewicht van waterstof (gelijkgesteld aan 1). Omdat hij wist dat men voorzichtig
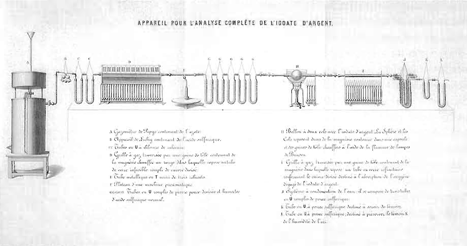
Apparaat ontworpen door Jean-Servais Stas voor de complete analyse van zilverjodide. In: Nouvelles recherches sur les lois des proportions chimiques, sur les poids atomiques et leurs rapports mutuels (Mémoires des members de l'Académie royale de Belgique, t. XXXV, 1865). Brussel, Académie royale de Belgique ▪
| |
| |
moet zijn met deze bepalingen, begon Jean-Servais Stas (1813-1891) met een reeks minutieuze onderzoeken in de hoop betrouwbare atoomgewichten te vinden voor zilver, chloor, stikstof, zwavel, kalium, natrium en lood. Aanvankelijk meende Stas dat hij de juistheid van Prouts hypothese kon aantonen, maar gaandeweg zag hij in dat ze niet houdbaar was. Hij zorgde echter wel voor een onweerlegbaar bewijs van de wet van de vaste verhoudingen die ook door Prout was gedefinieerd (zie artikel van H. Snelders).
Een andere grote hypothese die de evolutie van de scheikunde in de 19de eeuw heeft bepaald, is die van Amedeo Avogadro (1776-1856). Ze is een aanvulling op de atoomhypothese van Dalton: gelijke volumes van verschillende gassen, gemeten onder dezelfde omstandigheden van temperatuur en druk bevatten hetzelfde aantal deeltjes. Deze geniale hypothese maakte het mogelijk zowel de experimentele wet van Louis-Joseph Gay-Lussac (1773-1856), dat gasvolumes zich verbinden volgens verhoudingen die in gehele getallen kunnen worden uitgedrukt, als de wet van Boyle-Mariotte te begrijpen. De hypothese van Avogadro maakte het mogelijk de molecuulgewichten van talrijke gassen te bepalen. Deze opvattingen werden in dit positivistisch tijdperk niet onmiddellijk aanvaard, om filosofische redenen, maar ook omdat er verwarring was tussen atomen en moleculen. Pas op het Congres van Karlsruhe in 1860 kwamen de begrippen atoomgewicht en equivalentgewicht weer samen, en werd de basis gelegd van het chemisch atomisme. Vanuit dit gestabiliseerd begrip konden de structuurtheorieën eindelijk tot bloei komen.
| |
▪ Het einde van het vitalisme en de autonomie van de organische scheikunde: Louis Melsens
Al zeer vroeg in de geschiedenis was de scheikunde nauw verbonden met de levenswetenschappen en de geneeskunde. Door de spijsvertering of andere fysiologische activiteiten te beschouwen als een geheel van chemische reacties of door actieve stoffen te extraheren uit medicinale planten beoefende men nog niet de organische scheikunde, maar wel

Buste van Louis Melsens, door Charles Brunin. Brussel, Paleis der Academiën ▪
reeds de levenschemie. Had de opbloei van de minerale scheikunde lange tijd te kampen met de moeilijkheid het zuivere van het onzuivere te scheiden en daarna met het probleem van de identificatie van de bestanddelen, dan moest in het geval van de levende materie rekening worden gehouden met de complexiteit van de organische verbindingen die ondanks een beperkt aantal essentiële bestanddelen qua combinaties en mogelijke structuren oneindig veel talrijker en moeilijker te differentiëren waren. Deze technische moeilijkheid in de analyse speelde in de kaart van het vitalisme, die ervan uitging dat de chemicus in zijn laboratorium de natuur onmogelijk kon imiteren. De producten van de plantenen dierenchemie konden enkel worden verkregen via levende organismen die een bijzondere kracht bezaten, de levenskracht. Toen Friedrich Wöhler (1800-1882) in 1828 ureum produceerde uit ammoniumchloride en zilvercyanaat werd deze opvatting, die trouwens niet door alle chemici werd gedeeld, definitief weerlegd. De organische chemie nam hier een hoge vlucht en zou de onderzoeksthema's en de specifieke methodes van de chemische theorieën, die hoofdzakelijk waren afgeleid uit het rijk der mineralen, grondig transformeren.
Het begrip radicaal was een overblijfsel uit de eerder vermelde zuurtheorie van Lavoisier. Als een
| |
| |

Cours de Chimie générale Professé par mr. Kekulé à l'université de Gand. 1863-1864. Cursusnota's van Ed. Chumaz, handschrift. Leuven, Archief KULeuven ▪
min of meer complexe groep elementen die zich als geheel tijdens een chemische reactie van de ene naar de andere component transporteren, tonen de radicalen een chemische individualiteit die vergelijkbaar is met die van een element. Het bestaan van dergelijke radicalen werd aangetoond in 1815, toen Louis-Joseph Gay-Lussac vaststelde dat de CN-groep niet uiteenvalt tijdens reacties. De ontdekkingen volgden elkaar snel op: in 1832 vonden Friedrich Wöhler en Justus von Liebig (1803-1873) het radicaal benzoyl, in 1834 ontdekte Liebig het radicaal ethyl en in 1834-1836 vond Jean-Baptiste Dumas (1800-1884) het radicaal methyl. Deze radicalen lieten in eerste instantie toe het elektrochemisch dualisme van Berzelius uit te breiden tot de organische scheikunde. Bovendien bleken deze groepen bepalend voor de eigenschappen van de substanties die ze bevatten en leken ze de chemici een nieuwe weg te tonen naar een grondiger inzicht in de organische materie.
Rond dezelfde periode echter observeerde Dumas dat het bij de behandeling van bepaalde koolwaterstoffen mogelijk was een elektropositief waterstofatoom te vervangen door een zeer elektronegatief chlooratoom, zonder dat het karakter van het zuur noemenswaardig veranderde. Enkel zijn leerling Auguste Laurent (1808-1848) durfde toen stellen dat de mogelijkheid van deze substitutie de elektrochemische theorie ontkrachtte. Dumas kwam pas negen jaar later, in 1843, tot dezelfde conclusie. Dat jaar ontving hij in zijn laboratorium de jonge Belg Louis Melsens (1814-1886), die zijn opleiding wilde vervolmaken. Melsens slaagde erin de drie chlooratomen van het trichloorazijnzuur te vervangen door drie waterstofatomen, waardoor azijnzuur werd gevormd. Zo toonde hij experimenteel aan dat het fenomeen van de substituties algemeen is, vermits ze zich in de twee richtingen voordoen, en bracht hij de dualistische theorie van de materie een fatale klap toe ten voordele van de zgn. unitaire opvatting.
| |
▪ De triomf van de koolstofchemie: August Kekulé, Paul Havrez en Louis Henry
De organische chemie is een creatie van de 19de eeuw. Het pionierswerk van Michel-Eugène Chevreul (1786-1889) in Frankrijk en van Liebig in Duitsland kreeg snel navolging in verschillende Europese landen. Eerder is al duidelijk geworden dat dit deel van de scheikunde vaak de rol speelde van ‘spelbederver’ in de theoretische ontwikkeling vooraleer het er zelf de motor van werd. De door levende wezens gesynthetiseerde organische verbindingen zijn fragiel en pas wanneer de traditionele calcinatie- en distillatiemethoden vervangen werden door andere, minder agressieve analysemethoden konden de chemici vanaf 1810-1815 de samenstelling van deze organische stoffen beginnen identificeren. Het ging er niet alleen om de aard van de elementen te ontdekken (meestal koolstof, stikstof, zuurstof en waterstof), maar ook de verhoudingen in de geanalyseerde stoffen. Om deze componenten aan te duiden gebruikten Dalton en later ook Berzelius symbolen, afgeleid van de initialen van de Latijnse namen van deze elementen. Vanaf omstreeks 1830 werden de symbolen veralgemeend. Dat was een grote stap voor- | |
| |
waarts, want de organisch scheikundige wilde vooral een formule opstellen van de verbinding.
De jonge Louis Henry (1834-1913) was een briljant student te Leuven. Op advies van Laurent De Koninck (1809-1887) verbleef hij een jaar in het laboratorium van Giessen, waar Will de opvolging van de beroemde Liebig verzekerde. Hij oefende er zich in laboratoriumwerk aangezien dat tijdens zijn studies nooit aan bod was gekomen. Terug in België postuleerde hij voor de leerstoel scheikunde in Gent, maar die werd toegewezen aan August Kekulé (1829-1896). Deze benoeming had grote invloed op de verdere evolutie van de chemie in België.
Steunend op de Duitse traditie, opende Kekulé dadelijk een onderzoekslaboratorium dat jonge chemici aantrok zoals Adolf von Baeyer (1835-1917), Albrecht Ladenburg (1842-1911) en Wilhelm Körner (1839-1928). Gedurende zijn verblijf te Gent bedacht en formuleerde Kekulé het valentieconcept, dat verwijst naar de eigenschap van de atomen om een constant aantal aantrekkingscentra te bezitten waardoor zij zich verenigen met andere atomen of atoomgroepen. Voor Kekulé was deze valentie onveranderlijk voor ieder element. Zo is koolstof tetravalent, d.w.z. dat het vier (monovalente) waterstofatomen kan aanhechten om methaan te vormen (CH4). Deze valenties kunnen worden uitgebeeld met molecuulmodellen die veel gelijkenis vertonen met bouwdozen voor kinderen. De valenties worden voorgesteld door stokjes, de atomen door bolletjes of door ‘worstpakketjes’. Kekulé was niet de enige die molecuulmodellen gebruikte, wel integendeel. De meeste Europese chemici vonden het een nuttig instrument om er de denkexperimenten mee uit te beelden.
Het valentieconcept zou pas in de 20ste eeuw volledig worden begrepen. Kekulé leverde trouwens nog een belangrijker prestatie. Benzeen (C6H6) leek te ontsnappen aan de tetravalentieregel van koolstof: hoe kon men immers verklaren dat zes koolstofatomen met ‘slechts’ zes waterstofatomen zijn verenigd, terwijl in een simpele koolstofketen de zes koolstofatomen twaalf waterstofatomen aan zich binden? Zijn hypothese van een gesloten ring met een afwisseling van enkele en dubbele bindingen loste het probleem op, maar voorspelde ook een hele reeks isomere verbindingen. De achtereenvolgende ontdekkingen daarvan bepaalden het succes van Kekulé en zijn benzeenringtheorie.
Zoals vaak in de wetenschapsgeschiedenis kwamen meerdere geleerden tegelijk op hetzelfde idee. Dat de benzeenring zo snel werd aanvaard, komt juist omdat het concept dicht bij andere opkomende concepten stond. In België suggereerde Paul Havrez (1838-1875), directeur van de Ecole professionnelle van Verviers, een cyclische structuur voor de aromatische kernen in het artikel ‘Principes de la chimie unitaire’, verschenen in Revue universelle des Mines van 1865. Hij had zijn manuscript ingestuurd in november 1864, kort voordat Charles-Adolphe Wurtz (1817-1884) op 27 januari 1865 de benzeenformule verdedigde voor de Société chimique de France. In zijn artikel vermeldt Havrez de vruchtbare discussies die hij met Kekulé en anderen mocht voeren. Kekulé daarentegen vermeldde Havrez' ‘worstvoorstellingen’ enkel in de noten; later kwam hij er niet meer op terug. Het klopt dat Havrez zijn artikel heeft ingediend bij een tijdschrift dat in de academische wereld amper werd gelezen. Dat was een bewuste keuze, want hij schrijft: ‘wij hebben het nuttig geacht de publicatie van deze notitie toe te vertrouwen aan de Revue
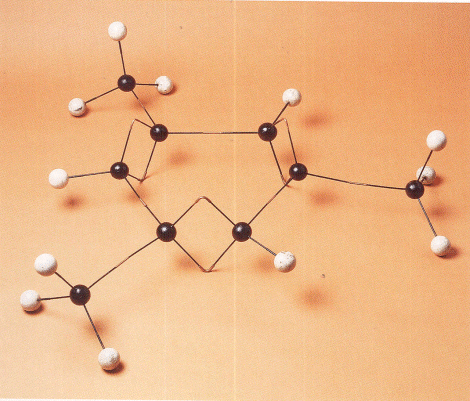
Benzeenmodel van August Kekulé. Gent, Museum voor de Geschiedenis van de Wetenschappen ▪
| |
| |
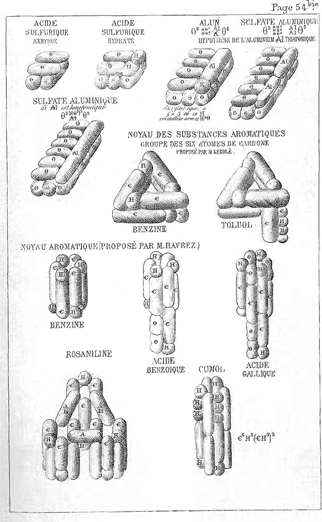
De formules van de aromatische kern volgens August Kekulé en Paul Havrez. In: P. Havrez, ‘Principes de la chimie unitaire.’ Revue universelle des mines, de la métallurgie, des travaux publics, des sciences et des arts, XVIII, 1865. Luik, Centre d'Histoire des Sciences et des Techniques ▪
universelle, om de ingenieurs, die niet ingewijd zijn in de nieuwe chemische theorie toegang te geven tot de studie van de recentste werken over de chemie’. Overtuigd van de gegrondheid van het gebruik van de structuurformules in de chemie, wilde hij aantonen ‘dat het in feite onmogelijk is door vlakke formules alle substitutiekenmerken te verklaren’. Men moest dus overstappen op een driedimensionale voorstelling van de moleculen. Parallel met de ‘worstvoorstellingen’ van Kekulé, schoof Havrez een gesloten ring van aan elkaar gebonden koolstof en waterstof naar voor. Deze schikking was niet alleen een voorafspiegeling van de benzeenring van Kekulé, maar liep ook tien jaar voor op de stereochemie. Door een volstrekt symmetrische verdeling van de bindingen te ontwerpen, die hem verplichtte fractievalenties te voorzien, kan het model van Havrez zelfs worden beschouwd als een geniale voorloper van de benzeenstructuur met gelokaliseerde p-bindingen. Havrez, een mijningenieur die zich moest toeleggen op het technisch onderwijs, was een bescheiden man met een zwakke gezondheid, die pas laat erkenning kreeg voor zijn intellectuele prestaties, niet van de scheikundigen of van zijn tijdgenoten, maar van de historici van de scheikunde.
Nadat hij zijn kans had gewaagd in Gent, werd Henry benoemd in Leuven, eerst als hoogleraar geologie in 1859, vervolgens als hoogleraar chemie in 1863, in opvolging van Martens. Hij deed er onderzoek op het domein van de organische scheikunde. Toen Henry in 1872 erin slaagde dipropargyl, een isomeer van benzeen, te synthetiseren, was dat een briljante bevestiging van de hypothese van Kekulé. De isomeren zijn verschillende moleculaire constructies die opgebouwd zijn met identieke materialen; het structuurverschil wordt vertaald in verschillende eigenschappen. In dipropargyl zijn de koolstofatomen aan de uiteinden van de koolstofketen verenigd met de naburige koolstof met een drievoudige binding en dragen zij een waterstof. De schrijfwijze van de structuurformule waarbij de valentie door één streepje en enkele (dubbele) bindingen door één (twee) streepje(s) worden voorgesteld, laat toe snel alle mogelijke configuraties te vatten.
Door zijn experimenteel talent kon Henry in 1886 de equivalentie van de vier actie-eenheden van koolstof aantonen. Deze hypothese, die de schrijfwijze van ontwikkelde formules ondersteunt door het gebruik van substitutiereacties, vroeg om een verificatie. Henry heeft, dankzij zijn ervaring en experimenteel vernuft, drie nitromethanen (d.w.z. methanen waar één van de waterstoffen is vervangen door het nitroradicaal) kunnen bereiden, waarbij het vervangend radicaal in drie verschillende posities werd geplaatst. Voor het vierde nitromethaan gaf hij alleen de modus operandi. Fysisch en
| |
| |
scheikundig vertonen deze producten identieke kenmerken, waarmee de equivalentie van de vier verbindingen was bewezen. Toen Henry in 1900 een scheikundige mocht voordragen voor de eerste Nobelprijs, noemde hij, zoals veel anderen, zonder aarzelen Jacobus Henricus Van 't Hoff (1852-1911). Maar in tegenstelling tot zijn collega's nomineerde Henry hem niet omwille van diens werk over osmotische druk, maar wel voor zijn stereochemie of ruimtelijke voorstelling van het koolstofatoom. Wat had men anders mogen verwachten van een chemicus die heel zijn leven als onderzoeker had gewijd aan de organische synthese?
Hoewel Henry overal werd erkend als een bekwaam experimentator, wat hierboven met enkele hoogtepunten werd geïllustreerd, vertoont zijn onderzoek een sterke coherentie: wanneer hij nieuwe organische verbindingen creëerde, was dat voor-

Louis Henry, Lithografie door L. Tuerlinckx. 1866. Leuven, Centrale Bibliotheek KULeuven, Prentenkabinet ▪
al om homogene reeksen op te stellen waarop men de fysische en chemische eigenschappen kon bestuderen. Hij werkte via substitutie en was overtuigd dat de vier valenties van koolstof een intrinsiek equivalente werking hebben; hij kon alleen maar opmerken dat eenzelfde element (of groep) gesubstitueerd in de plaats van bijvoorbeeld waterstof, geen gelijkaardige variaties induceert in de fysischscheikundige eigenschappen naargelang de gekozen substantie. Hij besloot daaruit: ‘De koolstofhoudende moleculen zijn, net zoals trouwens de samengestelde moleculen in het algemeen, maar dan op een veel duidelijker manier, echte organismen. De verschillende delen zijn onderling solidair vanuit het standpunt van de functionering. Deze invloedsrelatie vormt één van de belangrijkste problemen van de intramoleculaire chemie. Ik heb haar functionele solidariteit genoemd’. Om dit concept op een kwantitatieve basis te stoelen, werkte Henry samen met Nikolai Menschutkin (1842-1907), een Russisch fysisch scheikundige met wie hij correspondeerde en monsters uitwisselde. Het concept zou pas lang na het overlijden van zijn bedenker helder kunnen worden gedefinieerd als een fundamenteel thermodynamisch gegeven. Deze samenwerking tussen twee scheikundigen met een verschillende specialisatie is kenmerkend voor een nieuwe vertakking van de chemie: de fysische organische chemie.
| |
▪ De overgang naar de fysische scheikunde: Walthère Spring en Léon Crismer
Het vertrek van Kekulé had grote invloed op de scheikunde in België. Plaatselijk, d.w.z. aan de universiteit van Gent, werd het laboratorium dat hij mee had helpen opbouwen, verder ontwikkeld door Théodore Swarts (1839-1891), één van zijn leerlingen. Voor jonge Belgische chemici werd Kekulé's laboratorium in Bonn een geliefde bestemming; talrijke toekomstige professoren werden er opgeleid: de farmaceut-scheikundige Gustave Bruylants (1850-1925), Walthère Spring (1848-1911), Léon Crismer (1858-1944) en nog veel anderen.
Spring, van opleiding ingenieur, oefende zich te Bonn in de experimentele studie van de chemie en
| |
| |
de fysica. Hoewel hij een ingetogen karakter had, geeft zijn onderzoek blijk van een zeer grote originaliteit en een opmerkelijke technische vaardigheid. Zijn eerste werken over de moleculaire structuur van de polythionische zuren en de zuurstofverbindingen van chloor situeren zich in het verlengde van de opvattingen van Kekulé. Als specialist in het domein van de anorganische chemie, kreeg Spring een probleem voorgeschoteld dat zijn eigen competentie verzoende met die van zijn meester uit Bonn: het postulaat van de constantheid van de valenties, dat zoals we hebben gezien aan de basis lag van Kekulé's structuurtheorieën van de aromatische stoffen, uitbreiden naar andere elementen dan koolstof. Opmerkelijk is dat Spring, die in 1873 nog de overtuiging had tot een positieve conclusie te komen, gedwongen werd de constantheid van de valentie van de elementen opnieuw in vraag te stellen eens hij, naar het voorbeeld van zijn peter en mentor Stas, werd geconfronteerd met de experimentele realiteit. In 1876 schrijft hij: ‘Het atoom moet inderdaad een materieel ultimatum zijn dat chemisch niet meer deelbaar is; al de eigenschappen ervan moeten constant zijn, het moet een constant gewicht en een constant volume hebben, en vermits men aanneemt dat het vrij is, moet de beschikbare chemische kracht ook constant zijn’. Maar wat verder voegt hij daar nog aan toe, nadat hij de theorie van de veranderlijke valentie heeft uiteengezet: ‘wij geloven dat voor iedereen met filosofisch inzicht, de mogelijkheid zich een variatie in de eigenschappen van de atomen te kunnen indenken, de negatie van het atoom van Dalton met zich meebrengt: men moet uiteindelijk besluiten dat dit verondersteld ultimatum, de Protheus al naargelang de manieren waarop het door andere atomen zou zijn omvat, onder verschillende vormen kan worden voorgesteld, niet het atoom zelf is, maar een of ander complex’.
In Bonn volgde Spring de cursussen van een andere grootmeester: Rudolph Clausius (1822-1888), die in 1850 het tweede principe van de thermodynamica en de kinetische gastheorie had geformuleerd. Vandaar is het niet verwonderlijk dat hij in de marge van zijn chemisch onderzoek ook onderzoek in het domein van de fysica verrichtte. Hij besloot onder meer, op basis van proeven over de ontwikkeling van de statische elektriciteit en de elektrische verschijnselen die gepaard gaan met het wegstromen van kwik door capillaire buizen, dat elke oppervlakteverandering of aanhechting zich vertaalt in een elektrische toestand. Lang voor de ontdekking van het elektron - we zijn immers nog maar in 1876 - formuleerde hij het principe dat ‘elke verandering in de aantrekkingsenergie gepaard gaat met een verandering in de elektrische toestand’. In hedendaagse termen: de productie van statische elektriciteit wordt verklaard door het vrijkomen van elektronen uit atomen onder invloed van wrijving.
Aan zijn grote belangstelling voor het probleem van de gesteentevorming kan men zien dat Spring van opleiding mijningenieur was. Hij bestudeerde onder meer de invloed van hoge druk op vaste systemen. Hij besloot daaruit dat de druk zorgt voor een hecht contact tussen de oppervlakken maar dat de eigenlijke versmelting wordt voortgebracht door moleculaire diffusie. We mogen ons echter niet vergissen in het einddoel dat hij nastreefde: het kwam er niet zozeer op aan dit geologisch mechanisme te verklaren als wel het thema aan te grijpen om verder door te dringen tot het begrip van de cohesieverschijnselen en de fysische reacties tussen vaste stoffen. Hij slaagde erin om de diffusiebewegingen van de atomen en de moleculen in de vaste toestand aan te tonen, dankzij het gebruik van hoge druk én dankzij een opmerkelijk geduld (een van de systemen werd gedurende 17 jaar blootgesteld aan experimentele omstandigheden!). Ook hier pasten zijn observaties en de experimentele wetten die hij er uit afleidde perfect in het kader van de toepassing van het tweede principe van de thermodynamica op de studie van de chemische en fysische transformaties.
Spring legde zich ook toe op het onderzoek over de verspreiding van licht in diverse vloeibare en gasvormige milieus. De kleuring van het zeewater trok lange tijd zijn aandacht. Zijn onderzoeksveld omvat tevens de colloïdale fenomenen, de actiewet van massa's, de reactiesnelheden in hun afhankelijkheid ten aanzien van de temperatuur en de oplossingssnelheden van carbonaten in een zuur milieu. In al deze domeinen was de kinetische bena- | |
| |

Het Institut de Chimie van de universiteit van Luik. Luik, Centre d'Histoire des Sciences et des Techniques ▪
dering een kenmerk van zijn werk. Hij was dus wel degelijk een fysisch scheikundige, ook al deed hij geen beroep op de wiskundige analyse, die typisch is voor b.v. Willard Gibbs (1836-1903), noch op de concepten en formules van de thermodynamica, die hij nochtans kende.
Het klopt dat de chemici al lang gebruik maakten van de fysisch-scheikundige methoden (weegschaal, thermometer, dichtheid, spectroscopie). De fysische scheikunde beperkt zich echter niet tot het gebruik van deze methoden, wel integendeel. Zij omvat de studie van de mechanische, thermische, kinetische, elektrische voorwaarden van de chemische reacties. Het wiskundig instrumentarium en de zuiver natuurkundige benadering van de moleculaire transformaties vormen de kern van deze bijzondere tak van de scheikunde, waarin het concept energie een centrale rol speelt. Marcellin Berthelot (1827-1907) en Julius Thomsen (1826-1909) hebben de basis gelegd van de thermochemie. Ze wilden de warmteveranderingen die tijdens chemische reacties optreden bestuderen en begrijpen. De thermochemie zou pas in het meer algemene kader van de thermodynamica echt van start gaan. Lange tijd werden de chemici afgeschrikt door het doorgedreven wiskundig formalisme.
Jacobus Henricus Van 't Hoff, winnaar van de eerste Nobelprijs voor scheikunde, veralgemeende de wet van de ideale gassen tot stoffen in oplossing door het concept dampdruk te vervangen door osmotische druk, uitgeoefend door opgeloste stoffen. Het bestaan van deze osmotische druk werd onmiddellijk duidelijk door het gebruik van semipermeabele membranen, die impermeabel zijn voor opgeloste stoffen maar permeabel voor oplosmiddelen. Enkel elektrolyten, zuren, basen of zouten die de elektriciteit geleiden, leken aan deze wet te ontsnappen. Het mysterie werd definitief ontrafeld toen Svante Arrhenius (1859-1926) zijn theorie der elektrolytische dissociatie voorstelde. In oplossing dissociëren de elektrolyten in tegengesteld geladen ionen die elkaar in evenwicht houden. De verplaatsing van de ionen naar de elektroden verklaart de geleiding, en deze ionen gedragen zich zoals vrije moleculen, wat de geobserveerde afwijking met de wet van Van 't Hoff verklaart.
In het begin van de 20ste eeuw werd de fysische scheikunde de nieuwe, dominante richting binnen de scheikunde. Haar formalisme en methode heeft zich geleidelijk uitgebreid tot de organische chemie. In België is dit vrij laat tot stand gekomen, hoewel Walthère Spring in dit domein van de scheikunde reeds actief was geweest. Zijn geïsoleerd karakter en het onbegrip van zijn tijdgenoten hadden evenwel als spijtig gevolg dat het werk van deze pionier maar weinig invloed heeft gehad op de chemie in België.
Léon Crismer had een heel ander karakter. Net zoals Spring had hij in Luik farmacie gestudeerd. Hij trok nadien naar Straatsburg, een smeltkroes
| |
| |
van Duitse en Franse invloeden. Deze multiculturele ervaring was van groot belang. Zijn leven lang zou hij een synthese nastreven van de twee grote chemische tradities uit de 19de eeuw. Na Straatsburg trok hij naar Bonn, waar hij een jaar werkte op de Perkinreactie en haar wetten. Het probleem dat zich stelde bleek typisch voor de structuurtheorie: van welk koolstofatoom van het anhydride of van het corresponderende zout worden de twee waterstofatomen verwijderd tijdens de condensatie? Dit onderzoek gebeurde onder de leiding van Ludwig Claisen (1853-1932). Voor hij een post kreeg aan de Koninklijke Militaire School voltooide Crismer zijn ronde door Europa met een verblijf te Leipzig bij Wilhelm Ostwald (1853-1932) in 1893. Hij oefende er zich in fysisch-scheikundige werkmethodes. Crismer was dus niet alleen multicultureel maar ook polyvalent.
Zijn farmaceutische vorming oriënteerde hem naar de organische scheikunde. Zijn eerste onderzoek te Luik, tegelijk als assistent analytische scheikunde en als zaakvoerder van de universiteitsapotheek Peters-Vaust, waren van analytische strekking, in het domein van de mineralogie en in dat van de farmacie. Hij verrichtte ook veel analyses als expert in de geneesmiddelencontrole. Meer theoretisch onderzoek schrikte hem evenwel niet af. In 1878 stonden twee theorieën tegenover elkaar om het fenomeen spontane oxidatie te verklaren. De actieve zuurstoftheorie van Felix Hoppe-Seyler (1835-1895) beschreef de vorming van zuurstofwater door een oxidatie van het water dankzij één van de twee atomen van het zuurstofmolecule, vrijgekomen nadat het andere zich zou hebben vastgezet op een oxideerbare stof. De andere theorie, de primaire interventie van het water op het zelfoxiderend lichaam, verdedigd door Ludwig Traube (1818-1876), beschreef de fixatie van de volledige molecule van vrije zuurstof op de waterstof die ontstond om het zuurstofwater te vormen. Hoewel Crismer in Straatsburg bij Hoppe-Seyler had gestudeerd, volgde hij de stelling van Traube, met enige reserve in het geval van bepaalde spontane oxidaties in aanwezigheid van water. Hij bestudeerde er aandachtig de verschijnselen van en presenteerde in 1888 zijn eigen inzichten over dit fenomeen. Volgens hem fixeert het zuurstofmolecule zich aanvankelijk ‘en bloc’ op het koolwaterstofmolecule (hij baseerde zich daarvoor op zijn onderzoek van de spontane oxidatie van de terpentijnolie, citroen en eucalyptus) waardoor een peroxide wordt gevormd. Pas in een tweede fase kan dit peroxide uiteenvallen, hetzij in twee aldehydemoleculen, hetzij door te reageren op het water om zo glycol en zuurstofwater te produceren. Crismer anticipeerde op de theorie van de primaire peroxiden, die pas definitief zou worden vastgelegd in 1898 door André Job.
In deze periode reeds verdedigde Crismer de beginselen van de fysische scheikunde, die toen in steile opgang was. Bij meerdere gelegenheden gebruikte Crismer methodes die geïnspireerd waren door werken uit de fysische scheikunde om analyses uit te voeren die door hun precisie en deugdelijkheid zijn reputatie vestigden. Maar in 1891 was de fysische scheikunde niet langer louter instrumenteel; ze werd centraal in zijn discours. In een studie over de peptonen herstelde hij de stelling dat vlees dat verwarmd werd met water onder druk geen peptonen leverde terwijl de peptonificatie compleet was tijdens de actie van verdunde zuren. Met zijn studies trok Crismer ten strijde tegen de misleidende benamingen van bepaalde producten met een hoge voedingswaarde. Hij eiste dat het publiek de exacte samenstelling zou mogen weten. De analysemoeilijkheden zorgden er bovendien voor dat hij de neerslagverschijnselen nader ging bestuderen en alle recente literatuur over de oplossingstheorieën verslond. Zo kwam hij al snel tot het onderzoek van de kritische temperaturen voor de oplossing, wat zijn geliefkoosd onderzoeksveld zou worden.
In 1895 schreef hij: ‘De bepaling van de fysische constanten biedt over het algemeen onomstreden voordelen op de zuiver chemische methoden; ze zijn gewoonlijk erg gemakkelijk te bepalen en leiden snel tot het doel’. Het wordt ‘overbodig de op te lossen stof en het oplosmiddel te wegen of te meten’. Nadat hij deze nieuwe meetmethode op punt had gesteld, breidde hij het gebruik ervan uit tot analysedomeinen die hem toen bezighielden, d.w.z. het onderzoek van de voedselvervalsing maar
| |
| |

Medaille met portret van Léon Crismer. Brussel, Académie royale de Belgique ▪
ook de analyse van industriële oliën of springstoffen, waarbij ethylalcohol als oplosmiddel werd gebruikt. Hij maakte er ook gebruik van bij het doseren, het identificeren, en het meten van de zuiverheid of de reactiesnelheden. Op basis van een vergelijkende studie van de onderzoeksmethoden van de vervalsing van boter, die steunde op uitgebreide statistieken die rekening hielden met meetverschillen veroorzaakt door de vrije verzuring, stelde Crismer een (naar hem genoemde) index op om de zuiverheid te bepalen van boter die er van verdacht wordt vervalst te zijn met margarine. Crismer was dus in de eerste plaats een analist. Maar doordat hij als een van de eersten in onze streken het belang inzag van de fysische scheikunde en bijdroeg tot de verspreiding ervan, leverde hij pionierswerk in de toepassingsdomeinen van deze fysische scheikunde die de analyse konden bevorderen.
| |
▪ Besluit
‘Wij vertrokken nog voor zonsopgang, met een lantaarn; er was nauwelijks iets te zien. Bij het krieken van de dag, wanneer de ochtendnevel begon op te trekken, verscheen een wazig landschap, en hier en daar rezen uit de mist de onduidelijke gestalten op van enkele toppen; vervolgens begon de zon de uitgestrekte vlakte te bestralen, en wanneer, na volgehouden inspanningen, de eerste top werd bereikt, ontvouwde zich een grandioos schouwspel van een majestueuze schoonheid; lange bergkammen verbonden talloze toppen, en in de verte waren de nog niet verkende sneeuwtoppen te zien die tot in de wolken reikten’. (Léon Crismer, L'évolution de la chimie, 1930)
Deze enthousiaste en lyrische conclusie van Crismer sluit een eeuw scheikunde in België af. De sterke metafoor van een berglandschap dat bij de beklimming langzaam uit de mist opdoemt, is een prachtige uitdrukking van de geestdrift die de chemicus van het begin van de 20ste eeuw moet hebben gevoeld wanneer hij omkeek naar de reeds afgelegde weg. Toch bleven in het begin van de 20ste eeuw nog heel wat toppen te overwinnen. Het raadsel van de structuur van de materie zou pas volledig worden ontrafeld na de ontdekking van de structuur van het atoom en de kwantumeigenschappen van de chemische verbinding. Gewapend met nieuwe benaderingen zouden natuurkundigen profijt trekken uit de waarnemingen en theorieën die de scheikundigen hadden verzameld. Vooraleer de verafgelegen toppen werden bereikt moesten ook de in het citaat vermelde bergketens tussen de toppen worden overwonnen. Het kwam er dus op aan een uitgestrekt terrein nauwkeurig in kaart te brengen.
Wat waren immers de verbanden tussen de diverse domeinen van de chemie, die zich in de 19de eeuw steeds verder vertakte? Waren er geen minder toegankelijke of meer geïsoleerde domeinen die nog moesten worden bestudeerd? Voor ons land zijn er enkele illustraties. Albert Reychler (1854-1938) redigeerde met Les théories physico-chimiques het eerste Belgische traktaat over fysische scheikunde. Het werd meermaals heruitgegeven en vertaald. Reychler zette zijn onderzoek over fotochemie tot lang na zijn pensionering voort. En wat te zeggen van François-Marie-Louis Donny (1822-1896), die lang vóór Louis Pasteur (1822-1895) als autodidact de ene waarneming na de andere deed over de rol van ‘minuscule insecten’ tijdens het rottingsproces
| |
| |
van vlees, en die zonder dat hij er een interpretatie aan gaf spanningsverschijnselen in vloeistoffen bestudeerde die later ook door Berthelot werden bestudeerd? Er was ook nog de romantische figuur Paulin Louyet (1818-1850), een jonge scheikundige die stierf door vergiftiging met de toxische gassen van fluorverbindingen, die hij onderzocht omdat hij dit element, waarvan men het bestaan al sinds het begin van de eeuw vermoedde, wilde isoleren.
In deze schets van de geschiedenis van de scheikunde in onze streken wordt niettemin een algemene tendens zichtbaar die met twee woorden kan worden geduid: arbitrage en scepticisme. De nauwkeurige en vernuftige experimenten van Belgische chemici stelden meermaals een einde aan interpretatiekwesties. Zo was er Van Mons' interventie in de polemiek tussen aanhangers en tegenstanders van de flogistonleer, die vooral in de 18de eeuw populair was onder chemici in de Duitstalige wereld. Crismers werk was van doorslaggevend belang voor de oxidatietheorieën. Anderzijds kwamen theoretische speculaties en een onderliggende filosofie zelden voor. Hoewel er wel wetten en concepten voortkwamen uit de laboratoriumpraktijk, waren zij toch vooral van empirische aard, waren het geen algemene systemen. De experimentele wetten van Crismer of het concept functionele solidariteit van Henry zijn goede voorbeelden.
Deze algemene tendens had ook leerrijke uitzonderingen. Twee Belgische figuren hebben hun onderzoeksactiviteit openlijk in een veel breder filosofisch kader geplaatst: de reeds genoemde Van Mons en Maurice Delacre (1862-1938). Beiden hebben trouwens het woord ‘filosofie’ in de titel van één van hun werken gebruikt. Zij verpersoonlijken de wisselwerking tussen het wetenschappelijk onderzoek en de tijdsgeest, de ene in het begin van de eeuw, de andere op het einde. Van Mons illustreert de invloed van de ‘Naturphilosophie’ op de scheikunde door zijn drang de verschillende chemische, elektrische en magnetische krachten te verenigen. Delacre daarentegen stelt in de inleiding van zijn Histoire de la chimie: ‘In de experimentele wetenschap, bestaat er geen autoriteit. Ik heb de oorlog verklaard aan de hypothesen. Ik heb me ingezet om steeds de feiten te laten spreken’. Wat verder besluit hij: ‘scepticisme wordt aangeleerd door de geschiedenis’. In zijn Essai de philosophie chimique schrijft hij: ‘Werken aan de bevestiging van een theorie is geen werk’. En verder: ‘De chemie is een positieve wetenschap; haar positivisme is experimenteel; van alle wetenschappen is zij er het meest van doordrongen. Zij kan het zich permitteren alle hypothesen te verwerpen’.
Delacre was overtuigd van deze stelregel en beschouwde alleen de tabel met de atoomgewichten en de formules van de organische verbindingen als definitief vastgelegde hypothesen. Hij dreef de spot met de voorstellingen van de moleculaire structuren (of ze nu twee- of driedimensionaal waren), misprees het beeld van de benzeenring, negeerde de tabel van Mendelejev, stak de draak met de typen- en homologentheorieën, verzweeg de thermodynamica en het atomisme. De hypothese van Avogadro en het valentieconcept waren in zijn ogen van geen belang.
Zijn scepticisme, tot dogma verheven, zou zich steeds verder verwijderen van de ontwikkeling van de scheikundige wetenschap. Zijn Belgische tijdgenoten vervolgden echter het pad van de wijze wetenschappelijke voorzichtigheid en keerden zich steeds naar de internationale bronnen der kennis.
|
|