Heike Kamerlingh Onnes. Een biografie
(2005)–Dirk van Delft–De man van het absolute nulpunt
[pagina 287]
| |
19 Op de bres voor Van der WaalsDe continuïteit tussen de vloeistof- en dampfase, door Andrews in 1869 experimenteel bij koolzuur vastgesteld en vier jaar later door Van der Waals' toestandsvergelijking theoretisch onderbouwd, was het laatste kwart van de negentiende eeuw allerminst onomstreden.Ga naar eind1 Zeker, in 1822 had Cagniard de la Tour in een afgesloten buisje met vloeistof en damp bij verwarming op een gegeven moment de meniscus zien verdwijnen. Maar, zo vroegen onderzoekers zich af, wat gebeurde er eigenlijk met de vloeistof boven die kritische temperatuur? Meldelejev en Faraday opperden dat deze in de damp oploste en zijn identiteit behield, een standpunt dat in brede kring navolging vond. De opvatting dat damp- en vloeistofmoleculen van elkaar verschilden, dat de ene soort uit fragmenten van de andere bestond, viel tot ver in de twintigste eeuw te beluisteren, zij het steeds sporadischer. Tegengas bood vooral Leiden. Van 1893 tot 1907 bond het Natuurkundig Laboratorium de strijd aan met critici van de continuïteit en als argumenten niet hielpen deinsde Onnes er niet voor terug om proeven die Van der Waals' ongelijk zouden aantonen in eigen huis over te doen. Keer op keer bleken de buitenlandse experimentatoren misleid door factoren waar Leiden wél greep op had. Alvorens op dat tegenspel in te gaan eerst aandacht voor nog twee lijnen in de Van der Waals-serie: inwendige wrijving en capillaire opstijging.Ga naar eind2 Februari 1891 promoveerde Onnes' assistent Stoel op de temperatuurafhankelijkheid van de inwendige wrijving bij vloeibaar chloormethyl tussen het kookpunt (- 23oC) en de kritische temperatuur (143oC).Ga naar eind3 Vloeistof die door een buis stroomt bestaat als het ware uit concentrische ‘kokers’ die langs elkaar schuren en waarvan de buitenste tegen de wand ‘kleeft’. Een maat voor de inwendige wrijving is de snelheid waarmee de vloeistof door een dun buisje stroomt waarop een drukverschil staat (denk aan een buisje dat opzij uit een regenton steekt). Een empirische formule voor die stroomsnelheid was halverwege de negentiende eeuw opgesteld door de Parijse geneesheer Poiseuille. In die formule figureerde zowel het drukverschil, de afmetingen van de buis als de soort vloeistof. | |
[pagina 288]
| |
Aan Stoel de taak uit te zoeken hoe de wrijvingscoëfficiënt of ‘stroperigheid’ met de temperatuur varieerde. Dat moest een test van de theorie van Van der Waals opleveren. In zijn Algemeene theorie der vloeistoffen (1881) had Onnes de verhouding van de coëfficiënten voor twee vloeistoffen in overeenstemmende toestanden nabij de kritische temperatuur afgeleid.Ga naar eind4 Het experiment had heel wat voeten in de aarde. Omdat de kritische druk van chloormethyl 65 atmosfeer is werden aan de stevigheid van het twee meter lange glazen meettoestel hoge eisen gesteld. Vooral het schoonmaken gaf problemen: om de haverklap sprong het capillair. Maar toen de buis na vulling met chloormethyl maart 1890 werd afgesmolten, zat alles zo goed in elkaar dat driekwart jaar (en honderd metingen) later er nog altijd geen stofje de metingen in de weg zat. De temperatuur werd geregeld door de glazen buis in een vloeistofbad van water of glycerine te hangen. Een forse tegenvaller was dat alleen relatieve bepalingen van de wrijvingscoëfficiënt mogelijk waren: op een systematische fout kreeg Stoel geen vat. Absolute waarden kwamen er in 1894 alsnog met de verbeterde meetopstelling waarmee Marc de Haas het onderzoek voortzette.Ga naar eind5 Vergelijking van koolzuur (Duitse uitkomsten) met chloormethyl liet zien dat de wet der overeenstemmende toestanden ‘voldoende’ klopte, ‘in niet veel mindere mate’ dan bij andere toepassingen.Ga naar eind6 Dan capillariteit. Dat is het verschijnsel dat in een open nauwe glazen buis (capillair) die in een bak met vloeistof steekt het vloeistofoppervlak (meniscus) in geval de vloeistof aan het glas ‘plakt’ (zoals water) hol is en hoger staat dan in de bak, terwijl bij een vloeistof die niet plakt (kwik) de meniscus juist bol staat en het vloeistofniveau in het capillair tot beneden dat in de bak zakt. Januari 1893 presenteerde Van der Waals in de Akademie zijn Thermodynamische theorie der capillariteit.Ga naar eind7 Weer speelde continuïteit een sleutelrol, nu die van de dichtheid op het grensvlak vloeistof-damp. Vijf jaar eerder had een beknopte mededeling over de theorie Onnes' interesse gewekt. Januari 1893 ook promoveerde de in Amsterdam opgeleide E.C. de Vries bij Onnes op capillaire stijghoogtes bij ether (met 0,01 mm nauwkeurigheid bepaald met een kathetometer). Stabiele temperaturen waren essentieel: zodra zich in het capillair vloeistofdruppels of dampbellen vormden, was het over en uit met de meting. Zoals altijd waren correcties (bijvoorbeeld voor het niet vlak zijn van de meniscus) onontbeerlijk en beslissend voor de kwaliteit van de uitkomsten. Die gaven een lineaire daling van stijghoogte tegen temperatuur te zien. Maar boven de 160o traden afwijkingen op en in de buurt van het kritische punt (194oC) boog de grafiek horizontaal af. Voor De Vries was daarmee de kous af: net als Stoel werd hij hbs-leraar. | |
[pagina 289]
| |
Onnes presenteerde de uitkomsten tijdens de Akademiezitting van februari 1892.Ga naar eind8 Van der Waals, die zo het beslissende duwtje kreeg om zijn theorie der capillariteit in uitgebreide vorm te publiceren, liet in de Verslagen de Leidse Akademiemededeling vergezeld gaan van een Amsterdams commentaar. Hij had ‘gezocht’ in hoeverre zijn (beknopte) theorie uit 1888 klopte met De Vries' meetuitkomsten. Bij het naderen van de kritische temperatuur, zo leidde Van der Waals af, daalde de stijghoogte niet lineair (wat de theorieën van Laplace en Gibbs voorspelden) maar met een exponent ter grootte van 1,5. De zes meetpunten van De Vries, zo had hij uitgerekend, leverden 1,23 op. ‘Maar,’ zo eindigde Van der Waals zijn commentaar, ‘de waarden stijgen naarmate men [de kritische temperatuur] nadert en schijnen de stelling te bevestigen, dat de limietwaarde gelijk 3/2 mag gesteld worden.’ De wens was de vader van de gedachte. In Londen publiceerde de chemicus William Ramsay najaar 1893 eveneens metingen aan capillariteit.Ga naar eind9 De omvang van het Britse onderzoek was indrukwekkend. Waar De Vries met pijn en moeite bij één stof (ether) zes meetpunten had vergaard, kwam Ramsay met series van gemiddeld twintig waarden voor negen organische verbindingen. Onnes reageerde nogal zuur op dit machtsvertoon. Ramsay, zo schreef hij aan Van der Waals, zou de Leidse aanpak ‘weinig waarderend’ hebben besproken - de Brit vond De Vries' waarnemingen ‘niet talrijk genoeg’Ga naar eind10 - en ook had hij ‘verzuimd’ Van der Waals en Onnes de credits te geven voor een door hen afgeleide theoretische formule.Ga naar eind11 Van der Waals was prompt met de Britse uitkomsten aan het rekenen gegaan. Voor ether kwam hij uit op een exponent van 1,27 en voor benzol en azijnzuur op 1,23. Dat sloot aan bij de 1,23 die De Vries bij ether had gevonden, maar 1,50 was anders. Toch bleef hij die waarde trouw. ‘Daarenboven blijf ik nog menen,’ schreef hij Onnes terug, ‘dat in de absolute nabijheid van [de kritische temperatuur] de exponent 1,5 moet zijn.’Ga naar eind12 In een appendix bij de Duitse vertaling van zijn artikel over capillariteit nam hij ook Ramsays meetresultaten bij chlorobenzeen en koolstoftetrachloride mee. Van der Waals was zo eerlijk op te merken dat de exponent soms steeg bij het naderen van de kritische temperatuur, maar soms ook niet. ‘Of de limietwaarde [...] werkelijk gelijk is aan 1,5 valt op basis van deze waarnemingen niet te beslissen.’Ga naar eind13 Op dat moment had Onnes het onderzoek naar capillaire stijghoogten toevertrouwd aan de Belg Jules-Émile Verschaffelt. Die was in 1893 in Gent afgestudeerd en na een jaar Amsterdam naar Leiden geswitcht. In plaats van ether koos Verschaffelt voor koolzuur en stikstofoxidule (N2O; lachgas). De meetbuis met capillair werd net als bij De Vries op temperatuur gehouden | |
[pagina 290]
| |
door een vloeistofbad, ditmaal van kraanwater of chloormethyl. Op zijn beurt stak dat bad in een serie glazen die de warmte-isolatie verzekerden en bescherming boden tegen het springen van de meetbuis. Vanwege het dikke glas van die meetbuis duurde het soms uren eer er sprake was van temperatuurevenwicht. In zijn eerste publicatie, door Onnes tijdens de Akademiezitting van juni 1895 ingebracht, presenteerde Verschaffelt vier meetpunten bij koolzuur en drie bij stikstofoxidule.Ga naar eind14 Voor de exponent vond hij 1,311 voor koolzuur en 1,333 voor stikstofoxidule - als experimentator was Verschaffelt een klasse beter dan De Vries. Een jaar later kwam Verschaffelt met een nieuwe serie metingen bij koolzuur, ditmaal tot vlakbij de kritische temperatuur. Omdat de capillaire stijghoogten in die situatie tot onder een millimeter zakken, en de bolvormige meniscus in het capillair (een voorwaarde om correcties nauwkeurig te kunnen bepalen) alleen behouden blijft als de stijghoogte minstens tien keer zo groot is als de inwendige diameter, gebruikte de Belg een superdun capillair (diameter 0,0882 mm). In kleine stapjes stevende hij af op de kritische temperatuur (31,0oC). Op het laatst steeg de exponent van Van der Waals inderdaad richting 1,50. ‘Dit resultaat kan dus zeer bevredigend worden genoemd,’ concludeerde Kuenen in het gedenkboek van 1904.Ga naar eind15 Verschaffelt zelf toonde zich in 1896 heel wat minder stellig: hij had de benodigde dichtheden uit een Franse grafiek moeten aflezen en dat stuurde waarschijnlijk de einduitkomst.Ga naar eind16 In 1900, een jaar na zijn promotie op mengsels van koolzuur en waterstof, publiceerde Verschaffelt zijn definitieve artikel over kritische exponenten. Sidney Young, een leerling van Ramsay, had in 1894 superieure data van isopentaan gepubliceerd waarop de Belg, inmiddels leraar te Dordrecht, dezelfde analysemethode losliet als vier jaar eerder bij zijn metingen aan koolzuur. Weer bleef de exponent ruim onder de 1,50 van Van der Waals en van een stijging bij het naderen van de kritische temperatuur was hoegenaamd geen sprake. Dus schoot de klassieke theorie tekort.Ga naar eind17 Onnes, zijn hoofd bij mengsels en het pareren van aanvallen op de continuïteit, lag er niet wakker van. Over mankementen aan de toestandsvergelijking van Van der Waals kon hij na tien jaar Leidse experimenten als geen ander meepraten. Verschaffelts artikel zal hij hebben opgevat als sjorren aan een dood paard. Het zou tot de jaren zestig duren eer het besef bij fysici doordrong datklassieke toestandsvergelijkingen in het kritische gebied op fundamentele wijze tekortschieten.Ga naar eind18 | |
Over molécules gasogéniques en liquidogéniquesHet was William Ramsay die in 1880 de aanval opende op de notie van de | |
[pagina 291]
| |
continuïteit: er bestaat geen wezenlijk verschil tussen een vloeistof en zijn damp.Ga naar eind19 Ramsay, toen hoogleraar chemie aan het University College in Bristol, bestudeerde een aantal organische vloeistoffen met kritische temperaturen in de buurt van 200oC en constateerde dat zodra hij de afgesloten glazen buis met meer vloeistof vulde de temperatuur waarbij de meniscus verdween daalde, soms met wel 13o. Uit deze proef, aangevuld met andere, trok hij (als eerste) de conclusie dat verdamping gepaard ging met het zich opsplitsen (dissociëren) van moleculen in kleinere brokken. Beneden de kritische temperatuur, zo stelde Ramsay, mengden beide typen moleculen niet, erboven wel. In de tijd dat Kuenen in het Natuurkundig Laboratorium met proeven naar mengsels begon, vochten Louis Cailletet en zijn medewerker Collardeau in Parijs via een niet minder invloedrijk experiment het idee aan dat bij het kritische punt de dichtheden van vloeistof en damp samenvielen. In een glazen o-vormige buis, met op de bodem wat zwavelzuur, werd koolzuur geperst. Door de linkerkant af te koelen trad alleen daar condensatie op. Door het verschil in dichtheid tussen vloeistof en damp stond het zwavelzuur in die situatie in beide ‘benen’ niet even hoog. Bij verhitting van het geheel tot aan de kritische temperatuur van koolzuur verminderde dit hoogteverschil, maar verdwijnen deed het niet, ook niet enkele graden boven de kritische temperatuur. Kennelijk, aldus de Fransen, was de vloeistof nog niet volledig verdampt op het moment van verdwijnen van de meniscus - opnieuw in tegenspraak met de theorie van Van der Waals. De Italiaan Zambiasi herhaalde dit experiment in 1892, met dezelfde conclusie. Zo kon het gebeuren dat in 1893, het jaar dat Leiden de tegenaanval inzette, er een bonte serie waarnemingen op tafel lag, niet zelden onderling strijdig maar met als gemeenschappelijk kenmerk dat ze niet strookten met de continuïteit van Andrews en Van der Waals. In Luik constateerde de fysicus Pierre de Heen in 1892 dat bij ether de temperatuur waarbij de meniscus verdween juist steeg als er meer vloeistof in de buis stond (Ramsay rapporteerde in 1880 een daling). Ook berekende de Belg dat de dichtheid van verzadigde damp bij een en dezelfde temperatuur een serie uiteenlopende waarden kon aannemen die tot 50 procent van elkaar verschilden. En in Moskou publiceerde Boris Golitsyn, een nazaat van St. Peterburgse adel die zich in Franstalige publicaties Galitzine noemde, in 1893 een artikel waarin hij de dichtheidsverschillen van De Heen bevestigde en deze toeschreef aan de zich opsplitsende moleculen van Ramsay. Het probleem met deze experimenten was dat ze op een aantal fronten tekortschoten. De aanwezigheid van verontreinigingen, de soms zeer trage gang naar evenwicht in de nauwe proefbuizen, de rol van de zwaartekracht: | |
[pagina 292]
| |
al deze factoren werden niet op waarde geschat. Verder hadden de criticasters weinig benul van de theorie van binaire mengsels (pas in 1891 gepubliceerd). Lichtpuntje was dat Louis-Georges Gouy, hoogleraar natuurkunde in Lyon, in 1892 op de grote invloed van zwaartekracht in de onmiddellijke nabijheid van het kritische punt wees, veroorzaakt door de grote samendrukbaarheid in die situatie. Ramsay, wiens werk uit 1880 door het anticontinuïteitskamp volop werd geciteerd, kwam in 1894, toen hij ruime ervaring met onderzoek naar kritische stoffen had opgebouwd, tot het besef dat hij door verontreinigingen was misleid. In het Zeitschrift für Physische Chemie nam hij openlijk afstand van zijn vroegere standpunt dat een vloeistof ook boven de kritische temperatuur een eigen identiteit bezit: ‘[I]k voel me gedwongen nogmaals boete te doen door deze gelegenheid te baat te nemen om te verklaren dat ik niet langer in die onzin geloof; en ook om de gronden uiteen te zetten waarom men bij pogingen die deze ideeën lijken te steunen, zich gemakkelijk kan laten bedotten.’Ga naar eind20 Waarna hij de vloer aanveegde met Zambiasi, Galitzine en De Heen. Een jaar eerder had Kuenen dat ook al gedaan. Bij zijn onderzoek naar mengsels van koolzuur en chloormethyl, in 1892 bekroond met de ontdekking van retrograde condensatie, had hij in de praktijk ondervonden hoe traag temperatuurevenwichten zich instelden als er niet geroerd werd. Die traagheid was in de regel te wijten aan de aanwezigheid van verontreinigingen, zoals lucht. ‘Nieuwe theorieën omtrent zuivere stoffen schijnen mij dus ook vooralsnog overbodig ter verklaring van de kritische verschijnselen der stoffen,’ concludeerde hij oktober 1893 na alle afwijkende experimenten onder de loep te hebben genomen.Ga naar eind21 Zeven maanden later deed hij verslag van zijn versie van de proef van Galitzine. Na de u-buis volgens Leidse standaarden te hebben behandeld, bleken de door de Rus gerapporteerde dichtheidvariaties bij dezelfde superkritische temperatuur in Leiden als sneeuw voor de zon verdwenen. En passant ging Kuenen op theoretische gronden na wat de consequenties zouden zijn van aparte damp- en vloeistofmoleculen. Of die nu wel of niet in elkaar konden overgaan, hun bestaan leidde tot ongerijmdheden en zelfs absurditeiten.Ga naar eind22 Kamerlingh Onnes was in zijn nopjes met dit ‘lastige en zeer tijdroovende onderzoek’ en hoopte dat het effect zou sorteren.Ga naar eind23 Maar De Heen toonde zich allerminst onder de indruk van de kritiek die Ramsay en Kuenen over hem hadden uitgestort. In 1896 besloot hij tot de bouw van een apparaat om molécules gasogéniques en liquidogéniques te scheiden. Twee cilindervormige vaten, met zuigers die in tandem bewogen (zodat het totale volume constant bleef), werden gevuld met vloeibaar koolzuur. Beide vaten waren ver- | |
[pagina 293]
| |
bonden via een dunne buis met afsluitkraan. Nadat het bovenste vat was geleegd ging de afsluitkraan open, werd het geheel tot boven de kritische temperatuur verwarmd, waarna de kraan weer dichtging. Uit de dichtheidsverschillen die De Heen waarnam concludeerde hij dat het bovenste vat gasachtige moleculen bevatte en het onderste vloeistofachtige. Met een ernst een betere zaak waard zette Onnes zich aan de taak dit geknoei uit Luik recht te zetten.Ga naar eind24 Kort na publicatie bracht De Heen een bezoek aan het Leidse laboratoriumGa naar eind25 en nam Onnes de gelegenheid te baat zijn collega in te peperen ‘dat zeer kleine afwijkingen van temperatuur, druk en samenstelling in de nabijheid van den kritischen toestand tot groote veranderingen in dichtheid kunnen leiden’. Onnes had het sterke vermoeden dat De Heens koolzuur verontreinigd was, iets waar zijn collega tot zijn misnoegen ‘weinig gewicht’ aan hechtte. Wel kreeg hij De Heen zo ver dat hij zijn toestel naar Leiden stuurde, alwaar de proef met gegarandeerd zuiver koolzuur zou worden overgedaan met inachtneming van voorzorgen. Aan Verschaffelt (een landgenoot van De Heen) de taak om de analysateur de l'état critique te beproeven. Deze rook verdacht. Bij het openmaken bleken de pakkingen van de zuigers van leer gedrenkt in was of vet, stoffen die zo sterk in koolzuur oplossen dat het met de zuiverheid nooit goed zou komen. ‘Van den aanwezigheid van den toestel te Leiden kon dus alleen partij getrokken worden om eenige eigenaardigheden ervan te bestudeeren, en de zaak bleef verder rusten.’ Een jaar later herhaalde De Heen zijn claim van twee kritische dichtheden. De Belg sprak de hoop uit dat proeven met zijn analysateur overal ter wereld herhaald zouden worden. De uitkomst van die proeven liet zich raden, aldus Onnes. Waarna hij aangaf hoe men zo'n varkentje in Leiden waste: ‘Wie toch De Heen's dichtheidsbepalingen mocht willen overdoen, zal deze proeven wel in allen gevalle zoo wenschen in te richten, dat het mogelijk wordt zich van de homogeniteit van elk der phasen te overtuigen, en kleine verschillen in temperatuur, druk en samenstelling der te vergelijken phasen nauwkeurig te meten, teneinde daaruit voortvloeiende correctiën te kunnen berekenen.’Ga naar eind26 Verschaffelt en Onnes waren ervan overtuigd dat het toepassen van de benodigde correcties op de data van De Heen zijn uitkomsten binnen de meetnauwkeurigheid met de theorie van Van der Waals zou verzoenen. Waarna ze de daad bij het woord voegden en ‘uit verschillende in het laboratorium aanwezige stukken’ een toestel in elkaar zetten om De Heens bewering te checken. Omdat Verschaffelt intussen naar Dordrecht was vertrokken, nam Onnes de uitvoering op zich. Overigens vroeg hij zich af wat De Heens proef toevoegde aan die van Galitzine. De laatste was al in Leiden | |
[pagina 294]
| |
ontkracht. ‘Kwam het dus op beredeneering der stellingen van De Heen aan,’ aldus Onnes, ‘dan zouden wij er op kunnen wijzen dat al wat De Heen uit den proeven met den analysateur afleidt, door Kuenen's bestrijding van Galitzine a fortiori weerlegd is.’Ga naar eind27 Niettemin nam Onnes de proef op de som. De Leidse analysateur, een vereenvoudigde versie van die in Luik, werd met zuiver koolzuur gevuld en nadat De Heen inlichtingen had verstrekt over het bedienen van de kranenGa naar eind28 werden zijn experimenten overgedaan. Na afloop bleken de dichtheden in beide cilinders nauwelijks te verschillen. Onnes: ‘Er wordt dus eene geringe afwijking tegengesteld aan die van De Heen gevonden, welke uitkomst, de grenzen der waarnemingsfouten in aanmerking genomen, in de taal van De Heen zou luiden: de liquidogene en gazogene-moleculen zijn dezelfde.’ Vervolgens liep Onnes de foutenbronnen na die tot het Luikse verschil in dichtheid hadden geleid: temperatuurverschillen tussen beide reservoirs, verontreinigingen in het koolzuur en het niet toepassen van essentiële correcties bij het berekenen van dichtheden. Aldus was ‘voldoende het oordeel gerechtvaardigd’ dat De Heens proeven ‘geen recht geven om te twijfelen aan de juistheid en de volledigheid’ van het bestaan van één kritisch punt en van de continuïteit, zaken die de theorie van Van der Waals voorschreef. Sydney Young, aan wie Onnes de betreffende Communication had toegestuurd, was vol waardering over deze uitkomst: ‘I think that physicists owe you a debt of gratitude for having undertaken the laborious and somewhat thankless task of so carefully examining and, when necessarry, repeating Prof. de Heen's work. I do not see how any further doubt can now be felt on the matter.’Ga naar eind29 Ook De Heen dankte Onnes voor het toezenden van de gewraakte Communication, maar toonde zich allerminst overtuigd. Hij wees op de bijdrage van Galitzine aan het Congrès International de Physique van het jaar daarvoor, bij welke gelegenheid de Rus metingen van de brekingsindex in de buurt van de kritische temperatuur had gepresenteerd die op forse dichtheidsverschillen wezen - steun dus voor De Heen. Om de kwestie voor eens en altijd te beslissen dacht de Belg aan een commissie waarin Onnes, Verschaffelt, Mathias, Galitzine en hijzelf zitting zouden kunnen nemen. Ieder zou hetzelfde experiment met dezelfde apparatuur moeten doen. Onnes, als belangrijkste onderzoeker op het gebied van kritische verschijnselen, moest voorzitter worden. Overigens had de Leids-Luikse polemiek de goede verstandhouding tussen de partijen niet aangetast. Onnes werd uitgenodigd op zijn vakantiereis naar de Alpen een tussenstop in Luik te maken, en mevrouw Onnes en de kleine Albert kregen de hartelijke groeten.Ga naar eind30 Dat De Heen geen laatste der mohikanen was mag blijken uit het werk | |
[pagina 295]
| |
van Traube en Teichner. In 1902 lanceerde J. Traube, hoogleraar natuurkunde in Charlottenburg, de theorie dat bij verdamping fluidons (vloeistofmoleculen) expanderen tot gasons. Twee jaar later zette hij zijn student G. Teichner aan een ingenieus experiment dat het gedrag van superkritisch koolstoftetrachloride (CH4) in kaart bracht. In een glazen buis, voor de helft gevuld met die vloeistof, deed Teichner holle glazen bolletjes van enkele millimeters diameter met dichtheden om en nabij die van kritisch koolstoftetrachloride. De bolletjes zochten de hoogte op die paste bij hun dichtheid, waarmee de dichtheidsverdeling in de buis in één oogopslag zichtbaar werd. Wanneer de buis nu langzaam werd verwarmd tot boven de kritische temperatuur (282,2oC), bleek uit de verdeling van de bolletjes dat de dichtheid bovenin zo'n 25 procent lager lag dan onderin. Roeren verkleinde dit verschil, maar dat weerhield Teichner niet te concluderen dat zijn proeven die van De Heen en Galitzine bevestigden. 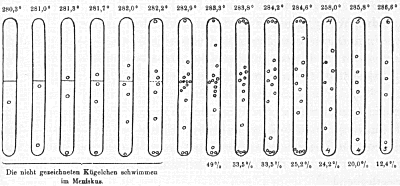 Proef van Teichner (1904). In een buisje vloeistof bevinden zich glazen bolletjes van iets uiteenlopende dichtheden. Omdat bolletjes blijven ‘hangen’ op de hoogte die bij hun dichtheid past, verraadt hun verdeling het dichtheidsverloop van de vloeistof in die buis.
Op het experiment, hoe elegant ook, viel van alles aan te merken. In 1903 had Teichner een van zijn proefbuizen naar Sidney Young gestuurd. Bij verwarming in zijn laboratorium in Bristol merkte Young dat de inhoud van de buis geleidelijk wat bruin kleurde (een teken van ontleding) en ook bleek het gas verontreinigd met een flinke hoeveelheid lucht. Toen hij de proef met zuiver koolstoftetrachloride herhaalde, was van een dichtheidsverloop geen sprake. Young stuurde buis en bolletjes terug naar Charlottenburg en lichtte Teichner in over zijn vulmethode.Ga naar eind31 In Leiden werd de proef van Teichner eerst op theoretische gronden bestreden. Sinds 1897 was in het Natuurkundig Laboratorium volop onderzoek gedaan naar mengsels, om de theorie van Van der Waals te testen en | |
[pagina 296]
| |
om de invloed van verontreinigingen kwantitatief na te kunnen gaan. Verschaffelt had de combinatie koolzuur-waterstof bij de kop gepakt,Ga naar eind32 Keesom enkele jaren later koolzuur en zuurstof.Ga naar eind33 Ook in theoretisch opzicht had dit tweetal zich met de effecten van verontreinigingen bezig gehouden.Ga naar eind34 Verschaffelt kwam dus beslagen ten ijs toen hij in 1905 de proef van Teichner aan een kritische analyse onderwierp.Ga naar eind35 Zo wist hij dat koolzuur verontreinigd met slechts 0,001 procent zuurstof dichtheidsverschillen teweegbracht van het formaat dat De Heen had opgemerkt. Dat Teichners waarnemingen de continuïteit van Van der Waals en Andrews zouden logenstraffen, ‘mag dus beslist worden ontkend. Tot in bijzonderheden kunnen die verschijnselen worden verklaard door de aanwezigheid van verontreinigingen, die langzaam door de stof diffundeeren, en berekeningen, die op de reeds bestaande gegevens berusten, hebben aangetoond dat, om een quantitatieve overeenstemming te krijgen, een mate van verontreiniging ondersteld moet worden van de zelfde orde als die, welke bij andere proeven met zogenaamde zuivere stoffen zeker bestond.’Ga naar eind36 Sidney Young reageerde opgetogen op Verschaffelts bevindingen.Ga naar eind37 Zijn brief naar Dordrecht kwam ook onder ogen van Onnes. ‘Hoe vriendelijk van je vrouwtje om die voor mij te copieren,’ haastte deze zich te antwoorden, ‘[...]zij heeft mij er een groot genoegen mee gedaan.’ Dat ‘een zoo beproefde autoriteit als Young’ zich vierkant achter Verschaffelt opstelde, was een felicitatie waard. Op het eind van zijn brief meldde Onnes zijn bondgenoot dat de ‘drijvertjes’ voor koolzuur zo goed als klaar waren. Leiden had besloten de proef van Teichner te herhalen, maar dan wel met het handzamere koolzuur. ‘De reeks over de Heen is af,’ zei Onnes erbij, ‘en nu wel afdoende weerleggend.’Ga naar eind38 Onvermoeibaar in zijn kruistocht tegen de tegenstanders van Van der Waals, het baken voor Leiden, liet Onnes april 1907, het vloeibare helium in zicht, nog één keer zien dat zonder verontreinigingen de gewraakte experimenten zich keurig naar de continuïteit voegden.Ga naar eind39 Het was leerling G.H. Fabius die de taak kreeg de experimenten van De Heen en Teichner met de nodige voorzorgen omkleed nog eens over te doen. Voor De Heen was het de tweede keer dat hij Leiden op zijn nek kreeg. Reden: in 1901 was het thermo-element in een van de reservoirs van de Leidse analysateur defect geraakt zodat toen de temperatuurcorrectie in het water viel. Met het verbeterde toestel werden tal van nauwkeurigheidsmetingen gedaan die van De Heens dichtheidsverschillen nog minder overlieten dan de eerste keer. De Leidse versie van de proef van Teichner profiteerde enorm van de gouden handen van Onnes' meester-glasblazer Herr Kesselring. Het lukte deze duivelskunstenaar boven en beneden in de buis een thermo-element | |
[pagina 297]
| |
te smelten zonder zwakke plekken te creëren (er stond tot 150 atmosfeer op) en om de lichtere glasbolletjes (‘zwevertjes’) te maken die pasten bij de dichtheid van koolzuur. Ook aan het vloeistofbad was veel zorg besteed. Het bevond zich in een niet-verzilverd vacuümglas met kleproerder, dat op zijn beurt eveneens in een bad met vacuümglas stond. Aldus viel de temperatuur tot op 0,002o te stabiliseren. Terwijl de temperatuur uiterst traag de kritische waarde passeerde (de proef liep van elf uur 's morgens tot negen uur 's avonds), werd het gedrag van de zwevertjes (verdeeld in negen dichtheidsklassen) nauwgezet gevolgd. Zoals te verwachten bleef van Teichners verschillen in dichtheid zo goed als niets over. ‘Wij menen tot een geringer gemeten verschil in dichtheid te zijn gekomen dan een der waarnemers voor ons,’ schreven Fabius en Onnes bescheiden én trots in hun Akademieartikel. Hielp het? Menig collega uit het anti-Van der Waals-kamp zal zich door de Leidse tegenacties hebben laten overtuigen. Zo niet Traube (Teichners chef) en De Heen. De laatste schreef in 1908 aan Verschaffelt, inmiddels docent experimentele natuurkunde aan de Vrije Universiteit in Brussel, nog altijd niet te geloven in de continuïteit tussen de vloeistof- en gasfase.Ga naar eind40 En in 1914 gaf Traube zijn student Hein opdracht de proeven van Teichner te herhalen. Morrend gaf de dissident uit Charlottenburg toe dat Heins uitkomsten beter met die van Fabius en Onnes klopten dan met die van Teichner. Niettemin weigerde hij zijn fluidons en gasons de deur uit te doen. Het zal Onnes een zorg geweest zijn. Het helium was in Leiden bezweken, de supergeleiding zojuist ontdekt en zowel Van der Waals als hijzelf had zijn werk bekroond gezien met een Nobelprijs. Traube deed maar. |
|

