2.
Schon sehr frühzeitig hatte man beobachtet, daß die Atomgewichte der chemischen Elemente so wie sie vom Chemiker bestimmt werden (d.h. auf O = 16 bezogen) nicht so viel von ganzen Zahlen abweichen, als das zu erwarten steht, wenn sie nach Zufall verteilt wären. Schon das wurde dahin gedeutet, daß ein genetischer Zusammenhang zwischen den verschiedenen Elementen bestehe und vielleicht letzten Endes alle Elemente auf Wasserstoff zurückführbar seien. Wirklich entwicklungsfähig aber wurde diese Idee erst, als man erkannte, daß die chemischen Elemente der klassischen Chemie in der Tat keine eigentlichen Elemente sind, sondern vielfach aus Atomgemischen bestehen, in denen die Bestandteile sich chemisch gleich verhalten, trotzdem ihre Atomgewichte verschieden sind. Besonders durch die Versuche von Aston, der die Massen bestimmte aus der Größe der Ablenkung von Strahlen elektrisch geladener Atome bei der Durchlaufung einer Kombination von einem elektrischen und einem magnetischen, ablenkenden Felde, sind unsere Kenntnisse über die Isotope, wie man solche Bestandteile genannt hat, sehr bereichert worden. In unserem Bilde
| |
bedeutet die Tatsache der Isotopie, daß man beispielsweise nicht nur einen einzigen Kern mit der positiven Einheitsladung und dem abgerundeten Atomgewicht 1 kennt, sondern daß die positive Einheitsladung auch noch verbunden mit anderen Massen auftreten kann. Dabei entsteht dann immer wieder ein Atom mit den chemischen Eigenschaften des Wasserstoffes, da diese durch das Elektron bedingt werden, welches in seiner Bewegung, abgesehen von kleinen Korrektionen, nur von der Ladung des Kernes und nicht von seiner Masse beeinflußt wird. Die verschiedenen Massen aber, die in Frage kommen, sind nun zwar auch nicht völlig, aber doch mit viel größerer Annäherung ganzzahligen Vielfachen der Wasserstoffkernmasse gleich als die klassischen Atomgewichte. So kennen wir heute 3 verschiedene Wasserstoffe mit dem abgerundeten Atomgewicht 1, 2 und 3. Man schreibt sie
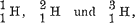
indem man durch den Stellenzeiger links unten die Ladung und durch den links oben die abgerundete Masse bezeichnet.
In der folgenden Tabelle I sind für die ersten 18 Elemente des klassischen periodischen Systems Daten angegeben. Die erste Spalte enthält die Ladungszahl Z des Kernes und damit die Nummer des Elementes, die zweite gibt das übliche chemische Zeichen, die dritte das abgerundete Atomgewicht A, die vierte die relative Häufigkeit der Isotope in Prozenten, die fünfte schließlich das genaue Atomgewicht (vom Kern plus Elektronen) bezogen auf O = 16 für das in der überwiegenden Häufigkeit vorkommende Sauerstoffisotop.
Man sieht, daß es Elemente gibt wie Fluor (F) oder Phosphor (P), von denen man noch keine stabilen Isotope gefunden
| |
hat; bei anderen Elementen wie Wasserstoff (H), Kohlenstoff (C) oder Sauerstoff (O) sind isotope Elemente mit geringerem Prozentsatz zugemischt; schließlich gibt es auch Elemente wie Bor (B) oder Chlor (Cl), die Gemische von Isotopen vergleichbarer relativer Häufigkeit sind. Am Anfang der Tabelle ist noch ein Element mit der Kernladungszahl 0, das vor einigen Jahren entdeckte Neutron aufgeführt, über das noch später die Rede sein wird. Daß die Massen nicht genau ganzzahlig sind, wird durch die letzte Spalte belegt. Die kleinen Abweichungen von der Ganzzahligkeit sind, wie sich nachher zeigen wird, von der allergrößten Bedeutung für die Beurteilung der Energieverhältnisse bei den Kernreaktionen.
Die Tabelle I wurde nach dem Bericht von J. Mattauch
Tabelle II
|
| Element |
Atomgewichte |
|
nach Bethe |
nach Rutherford,
Kempton und Oliphant |
| 10n |
1,0085 ± 0,0005 |
1,0083 ± 0,0003 |
| 11H |
1,00807 ± 0,00007 |
1,0081 ± 0,0001 |
| 21H |
2,01423 ± 0,00015 |
2,0142 ± 0,0002 |
| 31H |
3,01610 ± 0,00033 |
3,0161 ± 0,0003 |
| 32He |
3,01699 ± 0,00046 |
3,0172 ± 0,0003 |
| 42He |
4,00336 ± 0,00023 |
4,0034 ± 0,0004 |
| 63Li |
6,01614 ± 0,00050 |
6,0163 ± 0,0006 |
| 73Li |
7,01694 ± 0,00048 |
7,0170 ± 0,0007 |
| 94Be |
9,0135 ± 0,0007 |
9,0138 ± 0,0005 |
| 105B |
10,0146 ± 0,0010 |
10,0143 ± 0,0003 |
| 115B |
11,0111 ± 0,0011 |
11,0110 |
| 126C |
12,0037 ± 0,0007 |
12,0027 ± 0,0003 |
| 136C |
13,0069 ± 0,0007 |
|
| 147N |
14,0076 ± 0,0004 |
|
| 157N |
15,0053 ± 0,0005 |
|
| 168O |
16 |
|
| 178O |
17,0040 ± 0,0002 |
|
| |
(Phys. Zeitschr. 35, 567, 1934) zusammengestellt. Sie enthält daher die Atomgewichte so wie sie 1934 für richtig gehalten wurden. Inzwischen hat sich herausgestellt, daß auf Grund dieser Zahlen manche Kernreaktionen ganz unverständlich sind. Das hat zu einer Neuberechnung geführt einmal durch Bethe (Phys. Rev. 47, 633, 1935) und ein anderes Mal durch Rutherford zusammen mit A.E. Kempton und M.L.E. Oliphant (Proc. Roy. Soc. A 150, 253, 1935). Eine übersicht dieser neuesten Atomgewichte, welche nunmehr den Anforderungen genügen, gibt Tabelle II. |
|