De Tijdspiegel. Jaargang 35
(1878)– [tijdschrift] Tijdspiegel, De–
[pagina 275]
| |
Natuurkunde.Het vloeibaar maken van de lucht en van al de permanente gassen.In de eerste dagen van Januari laatstleden werd in alle nieuwsbladen het bericht eener groote ontdekking op natuurkundig gebied vermeld. Tegelijkertijd en onafhankelijk van elkander hadden Pictet te Genève en Cailletet te Parijs het zuurstofgas tot eene vloeistof verdicht. Kort daarop verscheen een nieuw bericht: ook de stikstof, (dus de geheele lucht) het kooloxyde, en het wonderbaarlijkst van allen, de waterstof waren door Cailletet verdicht; ja zelfs Pictet had de waterstof in vasten toestand verkregen. Niet alleen voor de beoefenaars der natuurwetenschappen, maar voor een veel grooter publiek was dit nieuws eene verrassing. Immers sedert de oprichting der middelbare scholen en sedert de invoering of uitbreiding van het onderwijs in de kennis der natuur op de kweekscholen en lagere scholen, hebben zoovelen kennis gemaakt met de zuurstof, de stikstof en de waterstof, dat in allerlei kringen met verbazing vernomen, en eerst nauwlijks geloofd werd, dat de lucht tot druppels was gemaakt en de waterstof tot ijs bevroren, zoodat men niet langer kon spreken van onverdichtbare of permanente gassen. Het sprak vanzelf, dat zulk een sensatiebericht door alle organen der pers werd geëxploiteerd. Na de couranten kwamen de tijdschriften, de populaire vooraan, en volgden alle illustratiën met afbeeldingen en meer of minder volledige beschrijvingen. Thans, in 't begin van April, behoort het onderwerp al weder tot het verledene en niet meer tot de orde van den dag. In de belangstelling van het publiek verdringt spoedig het een het ander. Alleen als de toepassing van eene ontdekking in het dagelijksch leven dadelijk gevonden en algemeen verspreid wordt, zooals dit bijv. met den telephoon het geval is, wordt de ontdekking niet vergeten. Bell's telephoon blijft ieder bekend; Pictet's en Cailletet's ontdekking blijft vooreerst alleen in de jaarboeken der wetenschap opgeteekend, tot er een tijd komt, dat zij eene toepassing in 't groot vindt. Wanneer ik iets meer over deze gebeurtenis wil vertellen, dan is het niet alleen om haar te beschrijven, maar ook om hare beteekenis en waarde toe te lichten. Laat ons kortelijk herinneren, dat op onze aarde de stoffen in drieërlei toestand voorkomen, vast, vloeibaar en gasvormig. Elk weet, dat men door warmte vaste stoffen kan doen smelten of vloeibaar maken, | |
[pagina 276]
| |
en door meerdere warmte gasvormig doen worden; omgekeerd dat men door afkoeling de gasvormige weder in den vloeibaren toestand en de vloeibare door sterkere afkoeling tot den vasten toestand kan doen terugkeeren; zoo als bijv. waterdamp tot water en water tot ijs. Maar bij vele stoffen (voor zoover zij zich niet ontleden) kan men de hitte niet hoog genoeg brengen om ze te smelten of te vervluchtigen, zooals bijv. de koolstof. Anderen kan men weder niet vloeibaar of vast maken. Zoo waren er vroeger verscheidene gasvormige stoffen, die men niet tot een vloeistof verdichten kon en daarom blijvende of permanente gassen noemde. Men heeft dit sinds lang daaraan toegeschreven, dat de afkoeling niet ver genoeg kon gebracht worden. In de tropische gewesten was ijs vroeger een onbekende zaak, evenzoo hebben in ons klimaat weinigen het kwikzilver vast zien worden. De noordpoolreizigers daarentegen zagen in hunnen thermometer het kwik bij 40 graden beneden nul bevriezen. Uit overeenkomst (analogie) heeft men dus reeds lang vermoed, dat, als men de koude veel sterker kon maken, tot 100, 200 of meer graden onder nul, het wellicht zou gelukken alle vloeistoffen vast en alle permanente gassen vloeibaar, ja, vast te maken. In het onderzoek van de natuur komt men slechts van stap tot stap voorwaarts. Elke nieuwe ontdekking, elke vooruitgang is altijd het gevolg van eene geheele reeks van voorafgaande ontdekkingen. Zoo is het ook hier gegaan. Cailletet en Pictet hebben de zuurstof, de waterstof enGa naar voetnoot(*) de overigen, die men permanente gassen heeft genoemd, niet vloeibaar kunnen maken, dan nadat in de laatste jaren vele eigenschappen omtrent de natuur van vloeistoffen en gassen ontdekt, ja, zelfs aan wiskundige berekening onderworpen waren geworden. De eerste ontdekking, die wij hier willen vermelden, is deze, dat behalve de afkoeling ook nog een ander middel de luchtvormige stoffen vloeibaar doet worden, namelijk samendrukking. Aan Monge en Clouet gelukte het reeds op het einde der 18de eeuw om het gas, dat bij de verbranding van zwavel ontstaat, gewoonlijk zwaveligzuurgas genaamd, tot een vloeistof te verdichten. Dit gas kan men ook door eene afkoeling beneden - 10o (dit wil zeggen 10 graden Celsius onder nul) vloeibaar maken, want het kookt bij - 10o (onder gewonen dampkringsdruk). Maar op de gewone temperatuur, dus zonder afkoeling, gelukt dit ook als men het gas brengt onder een sterkeren druk. Stel dat men dit gas in eene buis brengt, van boven gesloten en van onderen open, en deze onder kwik dompelt. Als men nu in een daartoe ingerichten toestel het kwik in de buis opperst, dan worden de gasdeeltjes in eene kleinere ruimte samengedrongen, verkrijgt het gas eene | |
[pagina 277]
| |
grootere dichtheid en oefent zelf een evenredig sterkeren druk uit. Men houde de temperatuur van het gas dezelfde. Zet men nu het oppersen voort en vermeerdert men steeds den druk tot 3 atmosferenGa naar voetnoot(*) toe, dan komt het oogenblik, dat het gas zijne grootst mogelijke dichtheid bereikt heeft. Want maakt men nu door verdere oppersing van het kwik het volume nog kleiner, dan gaan er deeltjes tot den vloeistoftoestand over, terwijl de overige gasdeeltjes dezelfde dichtheid behouden. Men ziet dan eene laag vloeistof en eene laag gas. Naarmate men het kwik verder naar boven perst, neemt de laag vloeistof toe en de laag gas af, totdat eindelijk alles vloeistof is geworden. Evenzoo heeft in 1805 Northmore het chloorgas door samenpersing verdicht. Nogthans werden deze proefnemingen weinig of niet bekend, zoodat toen de beroemde Faraday in 1823 het eerst de vloeibaarwording van vele gassen ontdekte, hij geheel onkundig was van de uitkomsten zijner voorgangers. Het chloorgas, het chloorwaterstofgas, het stikstofoxydule gas, het koolzuur, de ammoniakGa naar voetnoot(†) en anderen, die tot nog toe onder de permanente gassen gerekend werden, zijn door Faraday en Davij op hoogst eenvoudige wijze vloeibaar gemaakt. In een buisje werden de stoffen (a) gebracht, waaruit door verwarming eene groote hoeveelheid van een dier gassen scheikundig kon losgemaakt worden, de buis vervolgens omgebogen en bij b dichtgemaakt. 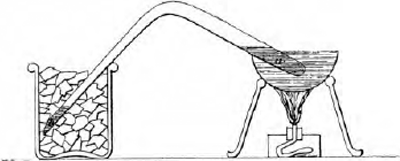 Als nu a verhit werd, ontwikkelde zich zooveel gas, dat op de gewone temperatuur eene ruimte daarmede kon gevuld worden, die veel en veel malen de ruimte van de buis overtrof. Daar de buis echter gesloten was, werd al dat gas samengeperst in de enge ruimte der buis. Het oefende daar een verbazenden druk uit, en onder dien druk werd het grootste gedeelte vloeibaar. Koelde Faraday nu den arm b af en hield den arm a warm, dan verzamelde zich het verdichte gas in b en kon daar waargenomen worden als vloeistof. Het was alleen noodig, dat de buis sterk genoeg was om onder den sterken druk niet uit elkander te springen. Zoo stond de zaak in het jaar 1823. Men stelde zich toen nog voor, dat een gas bestaat uit stof- | |
[pagina 278]
| |
deeltjes, die geenerlei samenhang hebben, maar integendeel elkander afstooten door de hun inwonende warmte. Voor sommige gassen was het genoeg ze sterk af te koelen, om de deeltjes hunne afstootende kracht te ontnemen, en ze tot samenhang te brengen, zoodat zij vloeibaar werden. Bij andere gassen kon men die noodige afkoeling niet sterk genoeg maken, maar dit vergoeden door ze in eene engere ruimte samen te persen, waarbij dan de aantrekking de overhand boven de afstooting verkreeg. Afkoeling en samendrukking tegelijkertijd moesten den samenhang spoediger teweeg brengen dan elk afzonderlijk. Door deze middelen hebben dan ook alle latere onderzoekers de permanente gassen trachten vloeibaar te maken. Uit de buisjes van Faraday kon men echter de vloeibaar gemaakte gassen niet nemen, om er proefnemingen mede te doen. Opende men ze, dan spoot de vloeistof er uit en was in een oogenblik weer vluchtig geworden. In 1835 stelde Thilorier een grooten toestel van gegoten ijzer samen, waarin hij 1 tot 2 liters vloeibaar koolzuur bereidde en in een afzonderlijken cylinder verzamelde, waaruit hij de vloeistof kon doen uitstroomen. En daarbij beloonde eene nieuwe ontdekking zijn streven. Het uitgevloeide koolzuur bevroor gedeeltelijk, en vertoonde zich als eene losse sneeuw, die eeniger tijd bleef bestaan en eene temperatuur bezat niet ver van - 100o verwijderd. Dit feit leerde, dat de neiging tot verdamping bij zulke vloeistoffen zóó sterk is, dat men daardoor eene tot nog toe niet bereikte afkoeling kan verkrijgen. Immers, als eene vloeistof verdampt, wordt veel warmte verbruikt om de deeltjes den gasvormigen toestand te doen aannemen. Die warmte wordt niet alleen ontnomen aan de wanden van het vat, maar ook aan de vloeistof zelve. Dit verschijnsel is algemeen bekend. Daarop berust het gebruik van natte omslagen tot afkoeling. Eenige druppels alcohol of aether op de hand gebracht verdampen snel en geven een sterk gevoel van koude. Brengt men kwik in vloeibaar zwaveligzuur (dat bijv. - 12o koud is) en laat het zwaveligzuur onder de luchtpomp snel verdampen, dan is de afkoeling zóó sterk, dat het kwik bevriest. Naarmate de vloeistof vluchtiger is, heeft die werking in sterker mate plaats. Het vloeibare koolzuur in een opene ruimte gebracht, verdampt verbazend snel aan hare oppervlakte met behulp van de warmte, die het aan de geheele hoeveelheid ontneemt; daardoor zinkt de temperatuur zeer laag, en wordt het punt bereikt, waarbij de vloeistof zelve bevriest. Sedert Thilorier heeft de techniek belangrijke vorderingen gemaakt. De cylinders van gietijzer, die zulke belangrijke drukking moesten weerstaan, waren gevaarlijk. In de stoomketels der locomotieven bedraagt de druk of spanning van den stoom ongeveer zeven atmosferen, en bij het vloeibare koolzuur bedraagt de druk bij 30o meer dan 70 atmosferen; 36 atmosferen bij 0o, 23 atmosferen bij - 20o. Een ongeluk bleef niet lang uit. Bij eene proefneming sloeg eensklaps de cylinder uiteen, en de assistent Osmin Hervey, een jong scheikundige, | |
[pagina 279]
| |
verloor op jammerlijke wijze het leven. Sedert werd een looden cylinder aangewend door een koperen omgeven, die nog met zware banden van smeedijzer was overdekt. (Mareska en Donny). Vervolgens stelde Natterer een veel eenvoudiger toestel te zamen. Hij pompte een zeer groot volume volkomen droog en zuiver koolzuur in een zware flesch van smeedijzer te zamen, die met een enkele klep van onderen en met een kraan en uitvloeiopening van boven voorzien was. Daardoor werd de proefneming niet alleen gevaarloos, maar tot eene collegieproef geschikt, die de hoogleeraren in de natuurkunde jaarlijks aan hunne toehoorders vertoonen. Ook andere gassen werden daarmede verdicht, zooals het stikstofoxydule. Men kan tegenwoordig bij Orchard te Londen zulke ijzeren flesschen gevuld met eenige kilo's vloeibaar koolzuur of stikstofoxydule bestellen. Zij worden met den spoortrein en de stoomboot verzonden als gewoon pakgoed, en ik kan mij herinneren, dat ik niet zonder eenige huivering op zekeren dag een Leidsche pakjesdrager met zulk een zware flesch vol koolzuur op zijn schouder het Laboratorium welgemoed zag binnenstappen. De man wist trouwens niet wat hij droeg. Sedert bleven de toepassingen op de nijverheid niet uit. De ijsmachines van Carré berusten op de verdichting van ammoniak. Is eene groote hoeveelheid daarvan in den toestel vloeibaar geworden, dan laat men ze snel verdampen; hierdoor ontstaat de geweldige koude, die eene groote hoeveelheid water doet bevriezen. Het is te begrijpen, dat men reeds meermalen getracht heeft door dezelfde middelen de overige gassen, die nog weerstand boden aan de vloeibaarwording, daartoe te dwingen. Evenals na de beklimming van den Montblanc of na het bereiken van den 80sten breedtegraad de lust wordt geprikkeld bij ondernemende karakters om nog hooger toppen of breedte te bereiken, zoo werd de lust wakker om nog grooter overwinningen te behalen op het gebied der gasverdichting. Het lag toch voor de hand aan te nemen, dat sterker persing bij zooveel mogelijke afkoeling tot de vloeibaarwording van zuurstof, stikstof, waterstof, kooloxyde, koolwaterstof noodig waren. Thorpe heeft onlangs medegedeeld, dat reeds in 1822 een zekere Perkins te Londen gemeend heeft onder een druk, dien hij op 1400 atmosferen schatte, de lucht en andere permanente gassen in een enge (capillaire) buis verdicht te hebben. Maar het komt mij voor dat Perkins, opgaven zelve de bewijzen leveren, dat zijne proefnemingen dit resultaat niet opgeleverd hebben, hetwelk op die wijze met de tegenwoordige theorie in strijd zou zijn. Ook in 1828 heeft Colladon te Genève zulks beproefd in een dergelijken toestel als Perkins vroeger en als Cailletet nu onlangs (veel verbeterd) heeft gebruikt. Colladon bracht den druk tot 400 atmosferen en koelde het gas tot - 30o, maar de permanente gassen bleven daarbij gasvormig. Ook de beroemde Berthelot te Parijs heeft niet lang geleden eene poging gedaan, en het gebracht tot een druk van 800 atmosferen bij eene temperatuur van ongeveer - 100o, doch tevergeefs. | |
[pagina 280]
| |
Het was dus duidelijk, dat men de hulpmiddelen nog niet bezat, of dat men met de natuur der permanente gassen nog niet genoeg bekend was om de juiste hulpmiddelen te kunnen kiezen. Intusschen was niet alleen de techniek vooruitgegaan in het bouwen van toestellen, die zulk een verbazenden druk konden uithouden, maar in de kennis van de natuur der gassen hadden de groote mannen der natuurkundige wetenschap merkwaardige vorderingen gemaakt. Men heeft sinds de laatste jaren een gas, als het in een verdunden toestand is, leeren beschouwen als een verzameling stofdeeltjes, geheel los van elkander, die zich in allerlei richtingen met eene verbazende snelheid door elkander bewegen en tusschen welke geene of althans in hoogst geringe mate aantrekkende of afstootende krachten werkzaam zijn. Opgesloten in een vat, trachten zij naar alle zijden te ontsnappen en oefenen daardoor op de wanden van het vat een druk uit. Wordt het gas warmer, dan gaan die deeltjes zich evenredig sneller bewegen en oefenen zij een grooteren druk op de wanden uit. Wordt het gas afgekoeld, dan gaan zij zich langzamer bewegen. De aard of scheikundige samenstelling van het gas bepaalt, hoeveel die vermeerdering of vermindering in snelheid der deeltjes voor elken graad verwarming of afkoeling bedraagt en wat daarvan verder de gevolgen zijn. Terwijl nu de gasdeeltjes door elkander heen in allerlei richtingen zich bewegen, komen zij van tijd tot tijd zoo dicht in elkanders nabijheid, dat hunne onderlinge aantrekking in het spel treedt. Zoolang de snelheid der deeltjes groot genoeg is (zooals voor de permanente gassen op de gewone en nog lagere temperatuur het geval is), is deze aantrekking (cohaesie) niet in staat eenige gasdeeltjes, die elkander ontmoeten, te zamen te doen blijven en een vloeibaar deeltje te vormen. Maar als men nu sterker en sterker afkoelt, dan kan ten slotte de snelheid zoo klein worden, dat dergelijke samenpakking van deeltjes mogelijk wordt, met andere woorden, dat het gas tot een vloeistof verdicht wordt. Hoe laag nu de temperatuur is, waarbij de snelheid ver genoeg is verminderd, zal van den aard of de samenstelling van het gas afhangen. Elk weet, dat waterdamp bij eene drukking van 1 atmosfeer op 100o begint vloeibaar te worden. Boven vermeldde ik, dat zwaveligzuur onder denzelfden druk zulks eerst bij - 10o doet; een ander gas kan wellicht eerst bij - 100o beginnen. Als men nu dit vloeibaar worden bij hoogere temperatuur kan verkrijgen door vermeerdering van druk, dus door de deeltjes in een engere ruimte samen te persen (het gas dichter te maken), dan moet zulks aldus verklaard worden: de onderlinge afstand der deeltjes wordt kleiner en ten gevolge daarvan de werking der cohaesie versterkt. Zoo als wij boven zagen wordt zwaveligzuur vloeibaar bij - 10o, doch evenzoo bij 6o, mits men het dan samenperse door een druk van 3 atmosferen. Het is nu maar de vraag welke wetten hier gelden, en wat men dus door druk en temperatuur te zamen zal ver- | |
[pagina 281]
| |
mogen. Want men wist reeds dat bij temperaturen, die hoog boven het kookpunt eener vloeistof liggen, een zeer hooge druk hoe langer hoe minder een gas vermag samen te persen. Hieromtrent hebben nu de beroemde proefnemingen van Andrews en zijne navolgers tot de kennis geleid van de wetten, die de vloeibaarwording bepalen. Andrews vond voor het koolzuurgas en anderen ontdekten voor andere gasvormige
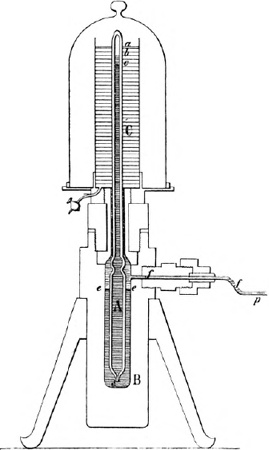 Toestel van Cailletet.
A is de buis, die het gas bevat, met eene opening bij d, waardoor het kwik uit B kan intreden. C bevat de afkoelende vloeistof, die het capillaire uiteinde der buis A omgeeft. Op de teekening is het kwik opgeperst tot c, en het gas gedeeltelijk als vloeistof kolom (van c tot b), gedeeltelijk nog als gas (in de ruimte van b tot a) aanwezig. Bij p is de perstoestel verbonden, die water door de buis ff tot op het kwik perst. Het kwik staat in B tot het niveau ee. stoffenGa naar voetnoot(*), dat er een grens bestaat voor de temperatuur boven welke men niet kan gaan, als men dat gas wil vloeibaar maken, al maakt men den druk ook nog zoo sterk. In den toestel, reeds door Perkins en Colladon gebruikt, namelijk een in kwik staand zeer nauw buisje, dat het gas bevatte, perste hij op eenvoudige wijze het kwik in de buis omhoog, zoodat ook het koolzuurgas werd samengeperst. Het buisje met gas werd in een doorschijnend vat geplaatst, dat door geschikte middelen op allerlei temperaturen verwarmd of afgekoeld kon worden. Bij eene zeer lage temperatuur, ongeveer bij - 80o, wordt het koolzuur vloeibaar, al bedraagt de druk niet meer dan | |
[pagina 282]
| |
1 atmosfeer. Maar bij 0o (dus als de buis door ijswater was omgeven) werd het gas eerst vloeibaar, toen hij het had gebracht onder een druk van 38 atmosferen. Een laagje vloeistof ontstond en dreef op het kwik. Bij toenemende samenpersing (door oppersing van het kwik) werd steeds meer gas vloeibaar. Ofschoon de druk in den toestel nu dezelfde bleef, nam de vloeistoflaag toe. Maakte hij nu de temperatuur van het gas hooger, dan moest hij onder sterkeren druk het kwik oppersen om het gas vloeibaar te maken (bijv. een druk van 49 atmosferen hij 13o), doch nog steeds gelukte dit, zoolang hij niet hoven 31o kwam. Boven die temperatuur kon hij zoo sterk persen als hij wilde, er vertoonde zich niets vloeibaars; hoe dicht de gasdeeltjes werden ineengedrongen en op elkander gepakt, geene vloeistoflaag scheidde zich af. Omgekeerd, als hij een buisje nam, waarin hij bij lage temperatuur koolzuur had verdicht (en dan het buisje toegesmolten), zoodat het een laag vloeibaar en daarboven een laag gasvormig koolzuur vertoonde, en hij dit buisje verwarmde tot 31o, dan verdween in een oogenblik de afscheiding tusschen vloeistof en gas, en ging alles tot gas over. Bij afkoeling beneden 31o kwam eene wolk en allengs een laagje vloeistof weer te voorschijn. Men heeft verder gevonden, dat voor verschillende gassen die grenstemperatuur verschillend is. Waterdamp kan men boven 412o niet vloeibaar maken, hoe sterk ook ineengedrukt; - aetherdamp niet boven 187o, - stikstofoxydule-gas niet boven 36½o, enz. Deze temperaturen noemt men thans de kritieke temperaturen. Zoo was dan een verband gevonden tusschen den invloed van druk en temperatuur op de vloeibaarwording, en moest men nu trachten te vinden, welke de kritieke temperaturen waren van de permanente gassen. Want het was duidelijk geworden, dat deze zeer laag moesten zijn, zoodat daarom tot nog toe geene samendrukking, hoe sterk ook, voldoende was geweest om ze vloeibaar te maken. Dr Van der Waals, thans Hoogleeraar te Amsterdam, heeft het eerst getracht om (door een stel van hypothesen en wiskundige formulen omtrent het verband, dat er tusschen al de ontdekte verschijnselen bij de gassen bestaan moet) tot eene berekening te komen van de aantrekking, die de gasdeeltjes op elkander uitoefenen, als zij tot samenkleving geraken. Daaruit kon hij dan weder berekenen, hoe laag de temperatuur moest zijn, waarbij eene vloeibaarwording het eerst mogelijk is, met andere woorden: de kritieke temperatuur der permanente gassen. Hij berekende die voor koolzuur op 32½o, en de proefnemingen hadden geleerd dat zij 30,9o bedroeg. Die overeenkomst tusschen berekening en proefneming bewees, dat zijne berekening wezenlijk waarde had. En daarom was dan ook aan de kritieke temperatuur, die hij voor de lucht berekende, namelijk - 158o, veel vertrouwen te schenken; zij kon van de waarheid niet veraf zijn. Het was dus zeker mogelijk om de lucht, dus de zuurstof en de | |
[pagina 283]
| |
stikstof, vloeibaar te maken; en het kwam er slechts op aan, zulk een lage temperatuur te bereiken en verder de bekwaamheid, den moed, de hulpmiddelen en het geld te bezitten, om de proefneming met eenige hoop op slagen te wagen. Wat nu de lage temperatuur betreft, daarbij kwam eene andere ontdekking uit den lateren tijd te stade. De verschijnselen, bij stoomwerktuigen waargenomen, hadden geleerd, dat men eene buitengewoon sterke afkoeling verkrijgt, als men een samengeperst gas plotseling gelegenheid geeft in eene ruimte uit te stroomen, waar zich een veel verdunder gas bevindt; dus bijv. stoom van hooge spanning in de vrije lucht. De theoretische studiën en berekeningen der verschijnselen hadden geleerd, wat er bij zulke plotselinge ontspanning van een samengeperst gas gebeuren moet, en dat er geen beter middel is om op een oogenblik de sterkste afkoeling te verkrijgen. Eenige nadere verklaring zou hier te ver leiden. Genoeg, dat er evenveel warmte wordt verbruikt bij de ontspanning, als men warmte zou moeten aanwenden om den arbeid van de samenpersing te verrichten. Een voorbeeld kan leeren hoe sterk de afkoeling is. Als eene hoeveelheid lucht tot de helft wordt samengeperst, en men laat haar eensklaps zich ontspannen door haar in gemeenschap te brengen met den vrijen dampkring, dan daalt hare temperatuur 24o. Wordt zij tot 1/10 volume samengeperst, tot 1/100, tot 1/1000, dan wordt de afkoeling in eene zekere reden grooter en grooter, en kan wel 100o ja 200o bedragen. Tot zoover was nu de wetenschap gekomen, toen in het vorige jaar Pictet te Genève en Cailletet te Parijs, zonder van elkaar te weten, opnieuw aan het werk togen om de permanente gassen vloeibaar te maken en - kon het zijn - te doen bevriezen. Zij wisten thans, waaraan zij zich te houden hadden. Alleen door druk konden zij hun doel niet bereiken, maar zij moesten bij een sterken druk eene veel en veel lagere temperatuur bereiken dan ooit bereikt was. De zuurstof of de lucht zou boven die zeer lage temperatuur nooit vloeibaar worden, al brachten zij een druk van 1000 atmosferen aan. En om die lage temperatuur te verkrijgen was slechts één middel in hun bereik, de afkoeling door zeer snelle en sterke verdamping, of door ontspanning, zooals wij die boven beschreven hebben. De arbeid van Pictet is nog grootscher en schooner dan die van Cailletet (de Franschen zullen dat niet erkennen, en doen natuurlijk alle moeite om de eer van de prioriteit aan Cailletet te geven), zoodat ik daarvan de beschrijving wil geven. Pictet kon over machtige hulpmiddelen beschikken. Er bestaat te Genève een gezelschap voor de vervaardiging van natuurkundige werktuigen, welks directeur, de Heer Turrettini, hem alles verschafte wat hij noodig had. Bijgestaan door dezen, door den Hoogleeraar Monnier, den assistent Walter, en den Ingenieur Bürgin bracht hij den toestel tot stand, waarvan nevensstaande figuur eene | |
[pagina 284]
| |
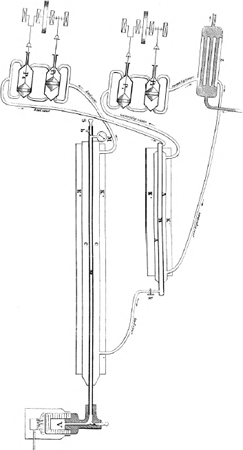 Toestel van Pictet.
| |
[pagina 285]
| |
schets geeft, en overwon hij alle bezwaren van technischen aard. Eene som van 50,000 franken was ermede gemoeid. Pictet begreep niet op eenmaal zulk een lage temperatuur te kunnen bereiken, en kwam op den vernuftigen inval om twee andere gassen als helpers te gebruiken. Door zwaveligzuur vloeibaar te maken en dit snel te laten verdampen, kon hij eene afkoeling tot - 40o verkrijgen. Door binnen in de buis met zwaveligzuur een tweede buis te brengen, kon hij onder een druk van eenige atmosferen daarin bij - 40o koolzuur verdichten. Door dit vloeibaar koolzuur te laten vloeien in een andere buis en snel te laten verdampen, kon hij het zeker wel beneden - 100o verkoelen; en nu moest hij beproeven wat hij onder zoo sterk mogelijken druk bij zulk een lage temperatuur kon verkrijgen. Hij bereidde een groote hoeveelheid zwaveligzuur in den houder Z, en vulde daarmede ook de buis A, die door een geleidingsbuis ermede verbonden is. De buis A ligt in de kist K gevuld met eene stof, die de warmte slecht geleidt. Vervolgens begon het spel van twee pompen (P1 en P2). Pomp P1 zuigt uit A en perst naar P2; P2 zuigt uit P1 en perst naar Z. Bij elken slag wordt dus eene groote hoeveelheid zwaveligzuurgas (3 liters), die natuurlijk uit de vloeistof verdampte, weggezogen uit buis A en overgeperst in pomp P2, die het op hare beurt terugperst naar den houder Z, waar het weer vloeibaar wordt, en den voorraad hierin weder aanvult; zoodat evenveel in vloeibaren toestand wordt overgeperst naar A. De houder Z wordt steeds door vloeiend water koud gehouden, dat door een inwendig stel pijpen loopt. Door dit voortdurend wegpompen van het zwaveligzuur ontstaat een groote koude; immers verdampt in een oogenblik een massa gas in de ruimte, die door de beweging des zuigers in den cylinder wordt opengesteld. Bij 80-100 pompslagen in de minuut werd een verlaging verkregen na 10 minuten tot - 45o en verder tot - 73o, terwijl de druk niet meer dan eenige atmosferen bedroeg, welken druk de pompen kunnen uithouden zonder lek te worden. Door het pompen steeds aan te houden, hield de afkoeling stand, niettegenstaande dat de toestel zich natuurlijk voortdurend verwarmde door de aanraking met de buitenlucht. Het koude water in den houder Z nam ten slotte deze warmte telkens weg. Nu ziet men op de teekening, dat de buis A inwendig bevat een tweede buis B, die alzoo even sterk wordt afgekoeld. In deze buis B pompte hij uit een gashouder (die in de teekening is weggelaten) een menigte koolzuur, geheel droog en behoefde dit onder niet meer dan 4 tot 7 atmosferen druk te doen, omdat de buis A reeds zoo koud is. Al dat koolzuur werd in de buis B dan even koud en daardoor vloeibaar en vulde haar grootendeels. Nu werd op hoogst voorzichtige wijze de gemeenschap gemaakt tusschen deze buis B en eene buis C, die in eene kist Kʺ daaronder ligt. Deze buis is verbonden met de pompen P3 en P4, die op dezelfde wijze werken als P1 en P2. De pijltjes geven de richting aan van den loop | |
[pagina 286]
| |
van het gepompte koolzuur. Het vloeibare koolzuur loopt door de kraan k naar de benedenhuis C en koelt deze sterk af; de pomp P3 pompt het weder weg, brengt het over in pomp P4; deze pomp perst het over in de bovenbuis B, waar het zich weder afkoelt aan het koude zwaveligzuur, vloeibaar wordt en terugloopt naar buis C. Dit spel wordt door het aanhoudend pompen steeds voortgezet. Door het wegpompen en dus verdampen van het vloeibare koolzuur uit buis C wordt daar telkens eene sterke afkoeling verkregen, en de warmte, die het gas in de pompen opneemt, wordt in de buis B steeds weggenomen, wijl het daar - 50o is. De afkoeling bedraagt in de buis C door het voortdurend verdampen zooveel, dat Pictet eene temperatuur mocht aannemen van - 140oGa naar voetnoot(*). Deze buis C is omgeven door eene stof, die de warmte slecht geleidt, in de kist K2; en binnen in die buis is een dikke koperen buis (inwendig 4 mM., uitwendig 15 mM.) gebracht, welke de zuurstof zal bevatten. Deze buis D is ter eener zijde verbonden aan een zeer sterk vat V van gesmeed ijzer, eene soort van bom, waarin zich de zelfstandigheid bevindt (kaliumchloraat), waaruit door verhitting zuiver zuurstofgas wordt ontwikkeld; ter andere zijde aan een mof met twee openingen en een schroef. In de eene opening is de drukmeter (M) bevestigd, in de andere een zeer fijn buisje (b), welks opening door het terugdraaien of indraaien van de schroef (s) kan afgesloten of in verbinding gesteld worden met de holte der mof. Nadat door voorloopige proeven was uitgemaakt, dat de toestel zich geheel in orde bevond, werden op den 22sten December 's morgens te negen uren de pompen P1 en P2 in gang gebracht, en de buisjes A en B door de aanhoudende verdamping van het zwaveligzuur afgekoeld tot beneden - 50o. Van half tien tot 10o 50′ werd het koolzuur uit een gashouder (800 liters) overgepompt in de buis B en vloeibaar gemaakt. Nu werd de bom met 700 gram kaliumchloraat gevuld en de lamp eronder gesteld, om allengs de zuurstof, die bij verhitting uit het kaliumchloraat vrij wordt en 191 liters bedroeg, in de enge buis D te brengen. Daarop werden de pompen P3 en P4 in gemeenschap gesteld met de buis C en de temperatuur van het vloeibare koolzuur spoedig op - 130o gebracht. Intusschen kwam er meer en meer zuurstof in D, en nam de druk toe tot 470 atmosferen, waarop zij bleef staan. Eene hoeveelheid van 191 liters zuurstofgas bevond zich samengeperst in eene ruimte van ongeveer 1 liter, want de bom had een inhoud van 944 CC en de buis van 52 CC, te zamen 996 CC. Pictet heeft later berekend, dat ongeveer ⅙ gedeelte der zuurstof in de enge buis was samengedrongen, en de overige ⅚ in den gloeiend heeten | |
[pagina 287]
| |
bom. Alles had zich goed gehouden. De pompen werkten voortdurend voort, geen lek deed zich voor. De buizen hielden den ontzaglijken druk uit en de groote koude bleef daarin bewaard. Het beslissende oogenblik was nu gekomen, om de schroef s terug te draaien en dus aan de samengeperste zuurstof de gelegenheid te geven, eensklaps door het buisje b in de vrije lucht uit te stroomen. Die plotselinge ontzaglijke ontspanning en uitzetting zou nog meer afkoeling te weeg moeten brengen, zoodat de temperatuur der uitstroomende zuurstofdeeltjes van - 140 nog wel honderd graden of meer moest zakken en er slechts eene geringe warmte in het gas kon overblijven. Te 1 uur 10′ draaide Pictet de schroef terug en werkelijk, een vloeibare straal drong met een vreeselijke kracht naar buiten. Aller oog volgde dien met eene tot de hoogste mate gespannen aandacht, en nam een schitterend witte kern daarin waar, omgeven door een blauwachtigen lichtmantel. Na drie of vier seconden sloot Pictet de opening weer af; de druk was tot 396 atmosferen verminderd, drie minuten later opende hij ze opnieuw voor een oogenblik, en verkreeg een tweeden straal vloeistof, die korter duurde en gevolgd werd door een gasuitstrooming, die duidelijk van den vloeistofstraal te onderscheiden was. Hoe groot moet de indruk geweest zijn op de toeschouwers, hoe onbeschrijfelijk de voldoening, die Pictet smaakte, en hoe moet de oude Colladon daarin gedeeld hebben, aan zijne proeven voor 50 jaar terugdenkende. Den 27sten en 29sten December werd de proefneming des avonds met denzelfden goeden uitslag herhaald, de laatste maal onder electrische verlichting. Te 8 uur begon de zuurstofbereiding in den bom. Te 9o 5′ was alles gereed en wees de manometer weder 471 atmosferen aan. Te 6u 16′ werd de kraan geopend, terwijl het electrisch licht een door spiegels geleiden straalbundel wierp, ter plaatse waar de straal moest uitschieten. Een menigte toeschouwers hielden thans de oogen op die plaats gevestigd, en Prof. Dufour uit Lausanne had een polarisatiekijker, met een Nicolsch prisma voorzien, daarop gericht, om door draaiing van dit prisma uit te maken of er eene lichtpolarisatie was waar te nemen, die een gevolg kon zijn van de aanwezigheid van vaste deeltjes. Toen nu de straal verscheen gedurende 2 of 3 seconden, zagen wel 20 toeschouwers duidelijk een binnenste deel, doorschijnend, 2-3 mM. dik, en daaromheen een schitterend witten mantel van 10-15 mM. dikte en 1 dM. lengte. Prof. Dufour nam tegelijkertijd een polarisatieverschijnsel waar. Het was dus duidelijk, dat de zuurstof vloeibaar uit de opening kwam, en dat een deel door het gasvormig worden van het buitenste gedeelte des straals zóó sterk zich afkoelde, dat het vast werd. Vandaar dat een witte sneeuw van vaste zuurstof zich gedurende een oogenblik om den vloeibaren straal vormde. Bij eene tweede uitstrooming 5 minuten later werd hetzelfde waargenomen, en had zich dus in den toestel opnieuw vloeibare zuurstof gevormd. Bij eene derde uitstrooming (de | |
[pagina 288]
| |
manometer wees 272 atmosferen) was de straal zeer gering, en bijna onmiddellijk bemerkten de aanwezigen, dat er alleen gasvormige zuurstof uitkwam benevens een wolk. Er was dus slechts een geringe hoeveelheid vloeibare zuurstof meer in de buis aanwezig, en overigens sterk samengeperst gas, waarin door de afkoeling bij de ontspanning nog een geringe hoeveelheid druppeltjes vloeistof konden gevormd worden, zoodat een wolk zichtbaar werd. Terwijl dit alles te Genève gebeurde en Pictet den 22sten December een telegram naar Parijs gezonden had aan het lid der Academie De Loynes, lag er reeds een gesloten bericht van Cailletet van den 2den December bij St. Claire Deville, waarin de woorden: ‘Ik heb heden zuurstof en kooloxyde vloeibaar gemaakt.’ Hij had door middel van waterdruk kwik opgeperst in de capillaire buis (A), waarin zich het gas bevond, zooals de figuur: toestel van Cailletet aanwijst, en het gas in de buis tot - 29o afgekoeld, door een koude vloeistof in een glazen vat daaromheen. Toen het gas onder den druk van 300 atmosferen was gebracht en dus zeer aanzienlijk samengeperst, opende hij eensklaps eene kraan in den cylinder, waarin het water sterk werd samengeperst; de druk van het water op het kwik hield dus op, evenzoo die van het kwik op het gas, en dit kon zich dus eensklaps weder uitzetten tot zijn oorspronkelijk volume, onder geweldige afkoeling. Die koude was groot genoeg, om enkele deeltjes een oogenblik vloeibaar te doen worden. Althans hij nam de wolk waar, die Andrews en zijn navolgers bij het koolzuur, het stikstofoxydule enz. onder dezelfde omstandigheden hadden waargenomen. Den 30sten December herhaalde hij de proef in het laboratorium der Ecole normale in tegenwoordigheid van Boussingault, Berthelot, St. Claire Deville, Mascart; - ook met stikstof. En allen namen niet alleen de wolk, maar ook druppeltjes gedurende een paar seconden waar. Ook met de lucht (het bekende mengsel van 4 deelen stikstof en 1 deel zuurstof), met moerasgas en met stikstofoxyde werd dezelfde uitkomst verkregen. De waterstof bleef nu nog over. Van haar was het te verwachten, dat zij onder alle gassen den grootsten weerstand zou bieden. Pictet liet zich niet lang wachten. Reeds den 10den Januari waagde hij de proef. Prof. Monnier hielp hem aan het noodige materiaal, om in den ijzeren bom uit een mengsel van zuivere mierenzure kalk en bijtende kali volkomen zuiver en droog waterstofgas te bereiden, in eene hoeveelheid die bij 0o en gewonen druk eene ruimte van ruim 300 liters zou innemen. Te zeven uur 's avonds begon de proefneming; de druk was even na 9 uur standvastig geworden en bedroeg nu 650 atmosferen. De schroef werd teruggedraaid; het electrisch licht verlichtte het tooneel. Een ondoorschijnende straal van een staalblauwe kleur verscheen gedurende enkele seconden, en daaronder een sterke wolk met een witten gordel; een knetterend geluid deed zich hooren en een geratel op den vloer, als van kleine | |
[pagina 289]
| |
hagelkorreltjes, die nedervielen. Waaraan anders kon dit toegeschreven worden dan aan vaste deeltjes, aan bevroren waterstof? Na sluiting werd de schroef opnieuw geopend, en een zeer korte straal waargenomen, benevens een uitwerping van vaste deeltjes, die zich van tijd tot tijd herhaalde; zoodat Pictet daaruit besloot, dat bij de geweldige afkoeling al de overige waterstof in de buis moest bevroren zijn. Dat de afkoeling werkelijk sterker moest zijn dan bij de zuurstof volgt daaruit, dat de vloeibare waterstof veel meer warmte verbruikt (dus aan zichzelf ontnemen moet) dan de zuurstof, om weer dampvormig te worden. Den 11den Januari ontving Dumas te Parijs het telegram van den gelukkigen uitslag. Dat de waterstof in de buis bij - 140o onder den druk van 650 atmosferen reeds vloeibaar is geweest, evenals de zuurstof, komt nog twijfelachtig voor, omdat de theorie deed vermoeden, dat de kritische temperatuur van de waterstof beneden - 140o ligt. Doch bij de afkoeling door de ontspanning moet een deel vloeibaar en vast geworden zijn. De zegepraal, door Pictet op zoo luisterrijke wijze verkregen, bewijst, tot hoe groote volkomenheid hij zijne wapens had gebracht. Zijn toestel is een meesterstuk van proefneming. Die iets weet van machinerie begrijpt wat het zeggen moet, om bij zulke drukkingen en temperaturen met pompen en buizen te werken. Ook is zijne ontdekking een glansrijke bevestiging van de theorie omtrent de natuur der gassen. Voorts blijkt, dat zulke ontdekkingen alleen mogelijk zijn, wanneer de theorie uit vroegere ontdekkingen tot een meerder verstandelijk (= mathematisch) inzicht in het verband der natuurverschijnselen of de krachten der stofdeeltjes heeft geleid Wanneer men nu vraagt, of deze ontdekking voor het oogenblik tot belangrijke nieuwe toepassingen in het dagelijksch leven aanleiding geeft, zooals bijv. de verdichting van den ammoniak tot de ijsmachines heeft geleidGa naar voetnoot(*), dan mag men met Franklin de vraag daartegenoverstellen (door Faraday reeds in 1817 aangehaald): ‘Wat is het nut van een kind?’ en het antwoord geven: ‘Tracht het nuttig te maken.’ Doch al mocht dit niet spoedig het geval worden, dan is het hooge belang der ontdekking niet te miskennen. Ik zoek dit niet daarin, dat wellicht spoedig het vloeibaar maken der lucht aan het groote publiek zal vertoond worden, dat tuk is op spektakel, of wel aan weetgierige leerlingen op de lessen in de natuur- en scheikunde. Van meer belang acht ik de waarschijnlijkheid, dat groote schei- en natuurkundige werkplaatsen weldra voorzien zullen worden van dergelijke meer en meer verbeterde toestellen, waarmede men de eigenschappen der grondstoffen en harer verbindingen bij zeer lage temperatuur zal naspeuren. Daardoor zal men in de | |
[pagina 290]
| |
kennis der natuurverschijnselen nieuwe vorderingen maken. En evenals de telegraaf, het electrisch licht, de telephoon, de mikrophoon, vruchten zijn, die van de wetenschappelijke onderzoekingen op 't gebied der electriciteit zijn afgevallen, zoo mogen wij hopen, dat nieuwe vruchten voor de maatschappelijke samenleving zullen geplukt worden, als de studie der vloeibare permanente gassen wordt voortgezet.
j.m. van bemmelen. |
|

