Heike Kamerlingh Onnes. Een biografie
(2005)–Dirk van Delft–De man van het absolute nulpunt
[pagina 78]
| |
5 Rusteloze atomenTerug in Groningen liet Heike zich bij de chemie van Tjaden Modderman niet meer zien en meldde zich bij Mees. Voor zijn plan de mechanica, de wiskunde en de mathematische fysica eens grondig door te ploegen was hij bij deze beschroomde maar capabele hoogleraar aan het goede adres. Hulp bij het experimenteren viel nauwelijks te verwachten: net als zijn Utrechtse leermeester Van Rees was Mees vooral theoreticus.Ga naar eind1 In zijn proefschrift De trillingsrichting in het rechtlijnig gepolariseerde licht had hij al laten weten dat experimentele hoogstandjes er niet in zaten: ‘ik gevoel mij niet in staat, om naast de te vermelden zoo nauwkeurige proeven van geoefende waarnemers er andere en even nauwkeurige aan toe te voegen.’Ga naar eind2 Bovendien had Mees in Groningen een zware onderwijstaak: naast natuurkunde gaf hij colleges in hogere wiskunde en astronomie. Binnen een maand was het gedaan met het schulmässig studeren. Mei 1873 verhuisde Heike naar Amsterdam, om assistent te worden bij J.W. Gunning. Die was in 1865 E.H. von Baumhauer opgevolgd als hoogleraar scheikunde aan het Athenaeum Illustre en stond er in zijn laboratorium aan de Groenburgwal vrijwel alleen voor. Jan Willem Gunning, een driftige domineeszoon, was een leerling van de veelzijdige Utrechtse hoogleraar Gerrit Jan Mulder. In navolging van deze ‘door jicht geteisterde militante persoonlijkheid’,Ga naar eind3 die hem in 1857 na een knallende ruzie zijn laboratorium uit had gezet, zwoer hij bij nauwkeurige waarnemingen. Ook bij Gunning had praktisch toepasbare chemie een streepje voor (hij was rijksadviseur bij het departement van financiën) en net als Mulder spande hij zich in het vak te populariseren. Het was Gunning die J.H. van 't Hoff in 1877 naar Amsterdam haalde. Gunning wist van Heike via Allard Pierson, zijn zwager. Op het eind van Heikes tijd in Heidelberg logeerde Gunnings oudste zoon, toen dertien jaar oud, in villa Intermezzo, waar de Piersons hun ‘heerlijk milieu van fijn geestesleven’ praktiseerden. Tegen het advies van Van Bemmelen in besloot Heike het aanbod van Gunning te accepteren. In Amsterdam trok hij op last van zijn ouders in bij zijn chef, die fraai aan de Plantage (Nieuwe) Prinsen- | |
[pagina 79]
| |
gracht woonde. Het assistentschap werd een faliekante mislukking; nog voor de zomervakantie zat Heike weer in Groningen. Zelf legde hij de schuld bij Gunning. ‘Zijn lokstem, die mijn jonge hersens op hol bracht, was in der tijd krachtiger dan uwe welmeenende raadgeving,’ excuseerde Heike zich bij Van Bemmelen, ‘hij heeft mij in den val gekregen. Hoe teleurgesteld, bedrogen zou ik bijna zeggen, en met hoeveel angels in het hart ik hem verlaten heb, heb ik totnogtoe niemand anders dan mijne ouders en mijn vriend Pierson [de zoon van Allard] toevertrouwd. Ik gevoel zelfs dat dat verblijf een uiterst nadelige invloed op mijn studien heeft gehad. [...] Zo veel tact als ik daar heb moeten ontwikkelen om zonder aan mijne eigenwaarde te kort te doen toch een modus vivendi te vinden, zal ik wel nooit weder nodig hebben.’Ga naar eind4 Voorlopig had Heike geen trek in nog een uitstapje. Toen september 1873 de Delftse chemicus C.J. Oudemans Jr. - alweer een leerling van Mulder met praktische belangstelling - een balletje opgooide (op voorspraak van Van Bemmelen), sloeg hij het aanbod beleefd doch beslist af. Een assistentschap aan de Polytechnische School was een aantrekkelijke gedachte, zeker nu Bosscha in Delft tot hoogleraar natuurkunde was benoemd en een spiksplinternieuw laboratorium had bedongen, maar Heike had even geen tijd. ‘Ik geloof dat het werkelijk beter voor mij is hier te blijven en op een latere gelegenheid te wachten, die mij naar Delft brengen kan.’Ga naar eind5 In Groningen stond niets een stevige duik in de theorie in de weg. ‘Hier [...] vind ik het vrij saai,’ schreef Heike in dezelfde brief aan Van Bemmelen. ‘Mijn vrienden verdwijnen ook langzamerhand, de studentensocieteit is vol van een jonger geslacht en zoo brengt mij alles er toe dezen winter geheel aan de studie te wijden.’ Wat nam Heike aan theorie tot zich? Een goed aanknopingspunt bieden zijn schriftjes met (college)aantekeningen en uittreksels van boeken en artikelen, alles dichtbeschreven en de etiketten netjes op de kaften geplakt.Ga naar eind6 In het Groninger programma zat een flinke scheut wiskunde. Heike verdiepte zich aan de hand van Aschenborns Lehrbuch der Arithmetik in de theorie der algebraïsche vergelijkingen, bestudeerde quaternionen (algebra met vectoren) en nam een stevige portie integraalrekening tot zich. Ook ploegde hij zich door het toen zeer bekende en luid bejubelde Treatise on Natural Philosophy, een lijvige inleiding in de natuurkunde van het Schotse duo Peter Guthrie Tait en William Thomson (de latere lord Kelvin). Opmerkelijk aan ‘Thomson & Tait’ was de centrale positie van het energiebegrip in het boek, ten koste van abstract-wiskundige bewegingsleer. Ook Jacobi's Vorlesungen über Dynamik en de jongste theorieën over elektriciteit en magnetisme van James Clerk Maxwell en Wilhelm Weber kwamen op Mees' colleges aan | |
[pagina 80]
| |
bod. Het was een combinatie van robuuste mechanica (de leer van beweging, kracht en evenwicht) en moderne, lang niet door iedereen gedeelde inzichten op het gebied van de thermodynamica (warmteleer) en de kinetische gastheorie. De laatste vat gassen op als legioenen kriskras door elkaar schietende en botsende atomen of moleculen en was tijdens Heikes studiejaren een hot topic. Het college mathematische fysica noemde Heike het ‘glanspunt’ in zijn Groningse onderwijs. ‘Hier kwam [Mees] uit in zijne volle kracht. Elke formule moest zich voor Mees in een gedachtengang oplossen, elk symbool in eene voorstelling. Hij was niet tevreden, vóór zijne toehoorders door alle wiskundige ontwikkelingen heenzagen; begrepen waarom zij op moeilijkheden waren gestuit, en hoe men tot het hart eener kwestie moest doordringen. [...] De bezieling voor de helderheid en doorzichtigheid van zijn vak wist hij in zijne leerlingen over te storten.’ Student Heike nam alles grondig tot zich en sprak pas een tentamen af als hij zeker van zijn zaak was: tegenover zijn strenge docent, voor wie hij de grootste waardering had, wilde hij coûte que coûte geen modderfiguur slaan. ‘[D]e gedachte, dat hij over mijne kennis van physica zou oordeelen,’ schreef hij in Mees' levensbericht voor de Akademie, ‘was voor mij voldoende, tusschen het candidaats- en doctoraal-examen een paar jaar langer dan men gewoon was te laten verloopen.’Ga naar eind7 Verloren tijd was dat niet: van de brede Groningse basis heeft Heike zijn leven lang plezier gehad. De kinetische gastheorie heeft Heike onder de hoede van Mees grondig bestudeerd. Zijn collegeschriftjes bevatten uittreksels van tientallen artikelen van pioniers als Clausius, Maxwell, Boltzmann, Thomson en Rankine. Tot het nieuwste werk dat in de schriftjes is terug te vinden behoort Over de continuiteit van den gas- en vloeistoftoestand, het befaamde proefschrift van J.D. van der Waals uit 1873. De theorieën van Van der Waals waren het baken waarop Heike Kamerlingh Onnes in Leiden koerste; voor het vloeibaar maken van helium waren ze van doorslaggevende betekenis. Maar laten we niet op de zaken vooruitlopen en eerst schetsen hoe thermodynamica en kinetische gastheorie er in Heikes Groningse jaren bij stonden, hoe het zover gekomen was en welke concurrentie ze te duchten hadden. Als leidraad fungeert het tweedelige The kind of motion we call heat van Stephen Brush, waarin deze Amerikaanse wetenschapshistoricus zijn tientallen artikelen op dit gebied heeft bijeengebracht.Ga naar eind8 | |
Van Boyle tot Van der WaalsStarten we de excursie met een bezoek aan Robert Boyle, de man die als een der eersten een toestandsvergelijking opstelde. | |
[pagina 81]
| |
‘Londen, 1675. Sla bij St. James's Palace in oostelijke richting, de zuidkant van Pall Mall op. Loop voorbij de huizen van gevierd geneesheer Thomas Sydenham en hofdame Nell Gwyn. Klop ongeveer halverwege de straat op de deur van een huis van drie verdiepingen, eigendom van Katherine, gravin van Ranelagh, en meld u bij het laboratorium aan de achterzijde, waar haar broer, de chemicus en natuurfilosoof Robert Boyle, de scepter zwaait.’Ga naar eind9 Aldus beschreef wetenschapshistoricus Steven Shapin op zwierige wijze de weg naar de plek waar de man van de wet van Boyle, geholpen door assistenten, zijn proeven met luchtdruk uitvoerde. In 1662 publiceerde Boyle een dik boekGa naar eind10 waarin hij kritiek op zijn ideeën pareerde, onder meer aan de hand van series experimenten. Druk maal volume is bij een afgesloten hoeveelheid gas en bij gelijkblijvende temperatuur constant, wezen die uit. In formule: pV = C. Het is een van de bekendste wetten uit de natuurkunde, al zei Boyle er direct bij dat hij niet de eerste was die het verband ontdekte. Eerder had hij gesteld dat lucht elasticiteit bezat en dat de horror vacui van Aristoteles diende te wijken voor een mechanische verklaring. Ter verklaring van het verschijnsel luchtdruk opperde Boyle als mogelijkheid atomen. Uitvoerig bediscussieerde hij in zijn werk de etherwervels die Descartes poneerde en die de deeltjes op afstand van elkaar hielden. Zijn voorkeur ging uit naar een statisch concept: luchtdeeltjes als veerkrachtige bolletjes wol. Dat verklaarde dat lucht zich niet zomaar liet samenpersen en de beschikbare ruimte geheel vulde. In 1738 was het Daniel Bernoulli die als eerste een kwantitatieve gastheorie met bewegende in plaats van statische moleculen opstelde. In zijn boek over hydrodynamica leidde de hoogleraar uit Basel een verband af tussen druk p, volume V en de snelheid v van de gasmoleculen: pV = ⅓ Nmv2 (met N het aantal moleculen en m hun massa). Bernoulli's tijdgenoten reageerden weinig enthousiast, pas in de negentiende eeuw werd het resultaat herontdekt en op waarde geschat. Een van de redenen voor de scepsis was dat Bernoulli zijn formule niet met temperatuur in verband wist te brengen. Lucht krimpt bij afkoeling, maar hoe? Een van de eersten die kwantitatief onderzoek deden naar het verband tussen volume en temperatuur van een afgesloten hoeveelheid gas, was de Franse natuurkundige Guillaume Amonton. Hij redeneerde eind zeventiende eeuw als volgt: omdat bij gelijkblijvende druk het volume evenredig is met de hoeveelheid warmte die lucht bevat, moet er een ‘absoluut nulpunt’ van temperatuur bestaan waarbij het volume gekrompen is tot nul. Uit aantekeningen over Amontons eigen proeven hebben wetenschapshistorici afgeleid dat hij op circa -240oC zou zijn uitgekomen (het werkelijke absolute nulpunt ligt op -273o). Ook Amonton werd door tijdgenoten genegeerd. Pas in 1802 stelden | |
[pagina 82]
| |
Charles en Gay-Lussac hun gaswet op: de druk loopt (bij gelijk volume) lineair op bij hogere temperatuur. Een vlotte invoering van een absolute temperatuurschaal, die vanaf het absolute nulpunt telt, leverde dat overigens niet op. In 1820 kwam John Herapath met de formule die Bernoulli eerder had afgeleid. De Brit liet zich wél uit over een samenhang tussen de temperatuur en de snelheid van de moleculen, al kwam hij uit op een lineair verband in plaats van het correcte kwadratische. Herapath wist als eerste met een kinetische gastheorie - dus met bewegende en botsende moleculen - uiteenlopende verschijnselen te verklaren, zoals diffusie van gas, faseverandering en voortplanting van geluid. Zelfs deed hij in 1832 een gooi naar de snelheid van de moleculen. Elf jaar later kwam J.J. Waterston, ook een Brit, voor lucht van 16o uit op circa 700 meter per seconde. Herapath en Waterston hadden de pech dat de Royal Society, bolwerk van het Britse wetenschappelijk establishment, hun ideeën over kinetische gastheorie te ‘wild’ vond om te publiceren. Toen vanaf 1850 pioniers als Krönig, Clausius en Maxwell zich aan het front meldden, was die gereserveerdheid verdampt. Dat had alles te maken met doorbraken in de thermodynamica of warmteleer: de wet van behoud van energie (Eerste Hoofdwet) en de onmogelijkheid dat bij een spontaan proces warmte van een koud naar een warm voorwerp stroomt (Tweede Hoofdwet). De Tweede Hoofdwet hangt nauw samen met het door Clausius ingevoerde begrip entropie. Entropie, een maat voor het aantal beschikbare toestanden waarin een systeem kan verkeren, kan alleen toenemen en bereikt bij evenwicht zijn maximale waarde. In 1856 raakte de kinetische gastheorie in een stroomversnelling. Die werd ontketend door een bescheiden artikel van August Karl Krönig, redacteur van Fortschritte der Physik.Ga naar eind11 Het bracht weinig nieuws, maar trok de aandacht van iemand die de theorie wel op een hoger plan bracht: Rudolf Clausius. Deze domineeszoon, na zijn baanbrekende werk op het gebied van de Tweede Hoofdwet in 1855 tot hoogleraar in Zürich benoemd, zag in de publicatie van Krönigs artikel aanleiding zijn eigen ideeën over de kinetische gastheorie op papier te zetten. In 1857 publiceerde Clausius in Annalen der Physik und Chemie een doorwrocht artikel dat bepalend zou blijken voor de richting die de kinetische gastheorie de rest van de eeuw insloeg: ‘Über die Art der Bewegung, welche wir Wärme nennen.’Ga naar eind12 Dat warmte met bewegende moleculen samenhing was geen issue meer, dat veronderstelde Clausius eenvoudig bekend. Moleculen zag hij als biljartballen die volkomen veerkrachtig met elkaar en de wand botsten en die naast translatie (rechtlijnige beweging) ook rotatie en vibratie te zien gaven. De Utrechtse fysicus Buys Ballot bracht tegen de nieuwe theorie in 1858 | |
[pagina 83]
| |
een op het eerste gezicht krachtig bezwaar in stelling.Ga naar eind13 Als de door Joule, Krönig en Clausius opgegeven snelheid van gasmoleculen inderdaad in de orde van honderden meters per seconde lag, aldus Buys Ballot, dan was het toch wel vreemd dat de rotte-eierenreuk van waterstofsulfide dat men in de ene hoek van een ruimte liet ontsnappen pas na enige tijd in de andere hoek viel waar te nemen. Om deze legitieme kritiek te pareren kwam Clausius met het idee van de ‘vrije weglengte.’:Ga naar eind14 een gasmolecuul botst voortdurend tegen soortgenoten op (van dichtbij stoten moleculen elkaar af) en legt in de praktijk dus louter kleine stukjes rechte weg af, steeds in willekeurige richting. Ook leidde de Duitser voor die vrije weglengte een formule af die weer in verband te brengen viel met eigenschappen als warmtegeleiding, viscositeit (stroperigheid) en diffusie. James Clerk Maxwell las Clausius' artikel in vertaling in het Philosophical Magazine en toog direct aan het werk om zelf een bijdrage aan de kinetische gastheorie te leveren. De Brit leidde op basis van een statistische benadering in 1860 een snelheidsverdeling voor de gasmoleculen af,Ga naar eind15 met als uitkomst een ‘klokfunctie’ (te vergelijken met de verdelingscurve van iq-waardes over een bevolking). Ook boog Maxwell zich over transportverschijnselen in gassen. Waarop de aanstormende Ludwig Boltzmann uit Wenen in 1868 Maxwells resultaten in een breder kader plaatste.Ga naar eind16 Wat de geloofwaardigheid van de kinetische gastheorie zeer ten goede kwam waren bepalingen, onafhankelijk van elkaar, van de afmetingen van het atoom. Op dit vlak gaf de kinetische theorie de nauwkeurigste resultaten. In 1865 berekende de Oostenrijker Joseph Loschmidt op basis van de vrije weglengte en metingen aan viscositeit de diameter van een luchtmolecuul op een waarde van een miljoenste millimeterGa naar eind17 (een factor vier te hoog). En in 1870 publiceerde William Thomson vier methodes (lichtverstrooiing, thermo-elektriciteit, capillariteit bij zeepbellen en vrije weglengte) die alle een min of meer vergelijkbaar getal opleverden.Ga naar eind18 Intussen had Ludwig Boltzmann enkele in het oog springende artikelen gepubliceerd die de kinetische gastheorie en de Tweede Hoofdwet via de weg van de statistiek met elkaar hadden verbonden. In 1868 gaf hij de door Maxwell afgeleide snelheidsverdeling van de moleculen van een gas een bredere basisGa naar eind19 en vier jaar later publiceerde hij een baanbrekend artikel over de wijze waarop een gas via een onomkeerbaar proces in thermisch evenwicht raakt: ‘Weitere Studien über das Wärmegleichgewicht unter Gasmolekülen.’Ga naar eind20 Het bevatte de afleiding van wat later het h-theorema is gaan heten en dat op atomair niveau liet zien dat de entropie in een gas onherroepelijk toeneemt, tot bij evenwicht een maximum is bereikt. Dat was een enorme stap vooruit. De macroscopische, door Clausius en Kelvin geformu- | |
[pagina 84]
| |
leerde wet was van een microscopische verklaring voorzien. Maar niet iedereen bleek overtuigd van de onontkoombare irreversibiliteit van Boltzmann en al snel kwam het h-theorema onder vuur te liggen. Altijd stroomt warmte van heet naar koud. Maar, zo merkte Maxwell al in 1870 op, deze irreversibiliteit was niet zozeer de uitkomst van een natuurwet maar kwam door het onvermogen van de mens om individuele atomen te manipuleren. Ter illustratie voerde hij het ‘duiveltje van Maxwell’ ten tonele.Ga naar eind21 Dat bezat het vermogen de opening tussen een vat met een heet gas en een vat met een koud gas alleen te openen als er toevallig vanuit het koude gas een snel molecuul aankwam, of vanuit het warme gas een traag molecuul. Omdat ‘heet’ of ‘koud’ bij een gas iets zegt over de gemiddelde snelheid van de moleculen, en bij individuele deeltjes er altijd uitschieters naar boven of beneden optreden, zal een geduldig duiveltje het als ‘poortwachter’ altijd voor elkaar krijgen dat warmte van koud naar heet stroomt. Wat zou neerkomen op een schending van de Tweede Hoofdwet - het kostte jaren de redenering door te prikken. In 1874 kwam William Thomson, overigens zonder op Boltzmanns h-theorema in te gaan, met een paradox: als botsende gasatomen voldoen aan de wetten van Newton, en die wetten behouden hun geldigheid als de richting van de tijd omkeert, hoe kunnen bewegende en botsende atomen dan ooit in de onomkeerbaarheid van de Tweede Hoofdwet resulteren?Ga naar eind22 Toen Boltzmann van deze irreversibiliteits-paradox hoorde, luidde zijn verdediging dat het eenrichtingverkeer van de Tweede Hoofdwet voortvloeide uit het enorme aantal moleculen. Het aantal mogelijkheden om zo'n legioen moleculen in een ‘ordelijke’ toestand te brengen (bijvoorbeeld: alle deeltjes in de onderste helft van het vat) is overweldigend veel kleiner dan het aantal mogelijkheden voor een wanordelijk geheel. En omdat het aantal wanordelijke toestanden zo hoog is, evolueert het systeem die kant op - een kwestie van statistiek. Het is in principe zeer wel mogelijk dat de parfummoleculen na verloop van tijd alle terugkeren in de geopende fles, alleen zal die bizarre situatie zich statistisch gezien pas na een astronomisch aantal jaren voordoen, een tijdspanne vergeleken waarmee de huidige leeftijd van het heelal een oogwenk is.Ga naar eind23 Tot slot van deze tour door thermodynamica - die in de jaren zeventig ‘voltooid’ zou worden door de Amerikaan J. Willard Gibbs - en kinetische gastheorie het proefschrift van Johannes Diderik van der Waals uit 1873. Over de persoon Van der Waals komen we later uitvoerig te spreken, hier gaat het om zijn toestandsvergelijking. Die betekende een aanpassing van de algemene gaswet (welke ontstaat door de wetten van Boyle en Gay-Lussac met elkaar te combineren). Luistert een ideaal gas naar de formule pV = RT | |
[pagina 85]
| |
 Johannes Diderik van der Waals (1837-1923), circa 35 jaar oud.
(met T de absolute temperatuur, gerekend vanaf het absolute nulpunt -273oC, en R de zogeheten gasconstante), bij reële gassen ligt de zaak ingewikkelder. Dan moet in rekening gebracht worden dat moleculen zekere afmetingen hebben (waardoor het effectieve volume daalt), ondoordringbaar zijn en elkaar aantrekken (wat zich uit in een extra ‘interne’ druk). In zijn proefschrift Over de continuiteit van den gas- en vloeistoftoestand werkte Van der Waals deze correcties uit,Ga naar eind24 met als resultaat zijn befaamde toestandsvergelijking: (p + a/V2(V - b) = RT. Hierin stellen a en b constanten voor die samenhangen met respectievelijk de grootte van de aantrekkingskracht die de moleculen op elkaar uitoefenen en het eigen volume dat ze als gevolg van hun afmetingen innemen (een berekening laat zien dat b gelijk is aan viermaal dit eigen volume). Deze toestandsvergelijking bleek uiterst effectief om de overgang van vloeistof naar gas theoretisch te beschrijven. Van der Waals, die heilig in atomen geloofde, zag in dat er bij een faseovergang niets met de moleculen en hun eigenschappen gebeurde en dat de sprekende verschillen tussen vloeistof en gas geheel zijn terug te voeren op de aantrekkende moleculaire krachten in het systeem. Van der Waals' toestandsvergelijking gaf tevens een verklaring voor het | |
[pagina 86]
| |
optreden van het fenomeen kritische temperatuur. In 1822 had de Franse onderzoeker Baron Cagniard de la Tour aangetoond dat een afgesloten hoeveelheid gas een kritisch punt bezit, corresponderend met bepaalde waarden voor druk, volume en temperatuur.Ga naar eind25 Boven de kritische temperatuur was alleen de gasfase mogelijk, onafhankelijk van de hoogte van de druk. Toen De la Tour in een van zijn proeven een glazen buisje vacuüm zoog, voor 40 procent met alcohol vulde en afsloot, merkte hij dat bij verhitting de vloeistof eerst uitzette, ten koste van het volume van de alcoholdamp. Tot op zeker moment de meniscus (vloeistofspiegel) zomaar verdween. De vloeistof, constateerde De la Tour, was overgegaan in gas. Maar de Fransman had net zo goed het omgekeerde kunnen beweren. Boven de kritische temperatuur, zo was de conclusie, verdween ieder onderscheid tussen vloeistof en damp en was er alleen nog gas. De waarde van die kritische temperatuur verschilt per stof: water 374oC, alcohol 243oC, koolzuur 31oC, zuurstof -118oC en helium (in 1895 op aarde ontdekt) -268oC, vlak boven het absolute nulpunt. Om zijn toestandsvergelijking te testen maakte Van der Waals dankbaar gebruik van de stortvloed aan metingen die de Franse experimentator Regnault sinds 1847 had uitgevoerd om correcties bij gasthermometers te bepalen. Ook metingen aan koolzuurgas (CO2), in 1869 gepubliceerd in de Philosophical Transactions van de Royal Society door Thomas Andrews uit Dublin, kwamen goed van pas.Ga naar eind26 Van der Waals las ‘On the continuity of the gaseous and liquid states of matter’ in Duitse samenvatting,Ga naar eind27 twee jaar na publicatie van het origineel, en het is waarschijnlijk dat hij zijn toestandsvergelijking toen al had opgesteld. In zijn boek Theory of heat uit 1871 tekende Maxwell op basis van Andrews' koolzuurmetingen in een p-V-diagram (waarin de druk is uitgezet tegen het volume) een aantal isothermen: krommen van gelijke temperatuur. Van der Waals reproduceerde ze in zijn proefschrift, om te constateren dat zijn toestandsvergelijking isothermen opleverde die zeer wel met experimenteel bepaalde curven in overeenstemming te brengen waren. Andrews' isothermen (zie de figuur) hebben bij hoge temperatuur een door de wet van Boyle gedicteerde vorm (een hyperbool), wat erop duidt dat koolzuur in die situatie zich als een ideaal gas gedraagt. Maar hoe lager de temperatuur, hoe groter de afwijkingen. Beneden de kritische temperatuur (31oC) gaan de isothermen bij samenpersen zelfs op een gegeven moment vlak lopen: damp begint tot vloeistof te condenseren. Is het horizontale stuk isotherm geheel doorlopen, dan resteert er louter vloeistof. Omdat nog verder samenpersen op grote weerstand stuit, buigt de isotherm op dat punt steil omhoog. Het kritische punt in het p-V-diagram is het buigpunt in een | |
[pagina 87]
| |
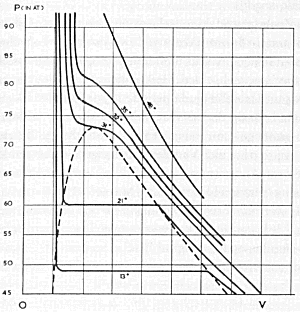 Isothermen van koolstofdioxide of koolzuurgas (CO2). Verticaal staat de druk, horizontaal het volume. Ruim boven de kritische temperatuur (31oC) volgen de isothermen de wet van Boyle, eronder lopen ze bij verkleining van het volume een stukje horizontaal en treedt condensatie op. De stippellijn geeft het gebied aan waar vloeistof en damp naast elkaar voorkomen (coëxisterende fasen).
bijzondere isotherm: die waarbij het horizontale traject tot nul is gereduceerd. Van der Waals' toestandsvergelijking levert in een p-V-diagram isothermen op die qua vorm netjes overeenstemmen met die van Andrews, inclusief het kritische punt. Alleen is het horizontale traject vervangen door een s-bocht, en wel zodanig dat de oppervlakten boven en onder de horizontaal gelijk zijn. De toestandsvergelijking mocht niet strikt wiskundig uit de kinetische gastheorie zijn afgeleid, op Boltzmann maakte hij zo'n verpletterende indruk dat hij Van der Waals betitelde als ‘de Newton van de theorie achter de afwijkingen die niet-ideale gassen vertonen’. Maxwell besteedde in Nature tot tweemaal toe aandacht aan Van der Waals' proefschrift (juni en oktober 1874),Ga naar eind28 waarbij de Brit zich op onderdelen kritisch toonde maar tegelijk zijn bewondering uitsprak voor hetgeen in De continuiteit gepresteerd was. Een jaar later, in een rede voor de Chemical Society in Londen, ging Maxwell zover zijn toehoorders aan te raden zich de ‘Low-Dutch language’ waarin deze ‘exceedingly ingenious thesis’ was geschreven, eigen te maken.Ga naar eind29 | |
[pagina 88]
| |
Toch is mijn leven zo solide mogelijkTerug naar Groningen. Zoals gezegd, kinetische gastheorie was in Heikes studiejaren een hot topic waarin de ontwikkelingen zich razendsnel opvolgden. Een veld dat een aanstormend fysicus tal van uitdagingen bood, zowel op theoretisch als op experimenteel gebied. Heikes dictaatschriftjes tonen zonneklaar dat hij, terug uit Heidelberg, de periode 1873-1876 niet alleen benut heeft om zich schulmässig de basisnatuurkunde eigen te maken, maar dat hij bovendien buitengewoon intensief met kinetische gastheorie in de weer is geweest. Hij maakte zich Van der Waals eigen (in hetzelfde schriftje staan uittreksels van Andrews en Cagniard de la Tour), de Abhandlungen 1 en 11 van Clausius (verzamelde artikelen), Maxwells ‘On the dynamic theory of gases’, de werveltheorie van Thomson en ook artikelen van Rankine en Boltzmann - de laatste in het kader van een college dynamische gastheorie van Mees - stonden op het programma. Hoe grondig Heike de zaken in Groningen aanpakte mag blijken uit een brief die hij met kerst 1874 naar Clausius in Bonn stuurdeGa naar eind30 en waarin hij uitvoerig commentaar leverde bij ‘Gleichung (17)’ van Clausius' artikel ‘Über die Zurückführung des zweiten Hauptsatzes der mechanischen Wärmetheorie auf allgemeine mechanische Principien’. Dat verscheen in 1871 in Annalen der Physik und Chemie en bracht Clausius ‘viriaaltheorema’ van het jaar ervoor,Ga naar eind31 startpunt voor Van der Waals bij het opstellen van zijn toestandsvergelijking, in verband met thermodynamica. De Duitse coryfee antwoordde prompt dat Heikes opmerking ‘ganz richtig’ was.Ga naar eind32 Tot oktober 1875, toen hij rector werd van de senaat van Vindicat atque Polit (zie het volgende hoofdstuk), moet Heike spijkerhard gestudeerd hebben. En getuige een schriftje met een artikel uit 1876 van de Brit S.H. Burbury (‘On the second law of thermodynamics in connection with the kinetic theory of gases’) heeft hij ook als rector de fysica niet vergeten. Al die inspanningen hadden hun weerslag op zijn gezondheid. ‘[Z]ie er mager uit,’ schreef hij april 1874 aan Van Bemmelen (zojuist tot hoogleraar scheikunde in Leiden benoemd), ‘ben spoedig vermoeid en dikwijls zonder lust aan 't werk. Toch is mijn leven zo solide mogelijk, mijn uitgaan bestaat alleen uit soupétjes, vooral bij de professoren, en festiviteiten waar ik noodzakelijk moet zijn.’Ga naar eind33 Ook op experimenteel gebied ging Heike met de kinetische gastheorie aan de slag. In de zomer van 1873, na het fiasco bij Gunning in Amsterdam, had hij in de instrumentenzaal van Mees in het Groningse Academiegebouw proeven gedaan naar ‘uitzettingscoëfficiënten van gedestilleerd’.Ga naar eind34 Omdat de nieuwe cursus aanstaande was en het reguliere practicum alle laboratoriumruimte in beslag nam, had Heike ze voorlopig gestaakt. Van het | |
[pagina 89]
| |
plan de draad in de volgende vakantie weer op te pakken kwam niets omdat hij toen met andere dingen bezig was. Eerst bouwde hij, aangezet door een prijsvraag en geholpen door amanuensis Deugten, een zelfontworpen toestel om de invloed van elektrische stroom op de torsie van een draad te bepalen. Het idee was een torsieslinger van metaaldraad te maken, die in een waterbad op constante temperatuur te houden en de slingertijden met en zonder stroomdoorvoer door de draad te vergelijken. Oktober 1873 was de opstelling, een robuust geheel, klaar en ging Heike ermee aan de slag.Ga naar eind35 Of de proeven bevredigend verliepen valt te betwijfelen: we horen er nooit meer van. Veel energie stak Heike in een proefopstelling om de kritische toestand van ammonia en zwaveligzuur te onderzoeken - evenmin een succes.Ga naar eind36 Dat experiment was ingegeven door een prijsvraag die Bosscha, kersverse hoogleraar natuurkunde in Delft, had uitgeschreven en die ‘abnorme dichtheden’ tot onderwerp had, te bepalen met de ‘luchtthermometer en wat daarmee in verband staat’.Ga naar eind37 Heike besefte dat het ‘wanhopig’ was nog op tijd een experiment op te zetten, maar het onderwerp interesseerde hem zeer en met de goedkeuring van Mees toog hij aan het werk. Voor hij met meten kon beginnen passeerde er bijna een jaar: het bouwen van de benodigde toestellen bezorgde Deugten flink wat hoofdbrekens. Intussen was Heike druk met ‘een menigte praeparatieven’ waarbij het vergelijken van gas- en kwikthermometers een vervelend karwei bleek.Ga naar eind38 Ter afwisseling bepaalde hij voor vriend Anton Tellegen (die in juni 1875 op het ‘primaire niersarcoom’ zou promoveren) in het fysiologisch laboratorium glucosewaarden in ‘diabetische urine’. De condities voor experimenteel werk op de bovenverdieping van het Groningse Academiegebouw waren nog steeds beroerd. ‘Het physisch kabinet is vrij goed voorzien, maar waar mede?’ merkte Heike cynisch op.Ga naar eind39 Om te vervolgen dat veel toestellen van ‘historische betekenis’ waren, goed voor collegeproeven, maar dat er maar één ijzeren statief met klem aanwezig was. Aan Mees had hij weinig. De hoogleraar fysica had een zware onderwijstaak, miste een assistent en het geld om een fatsoenlijk experimenteel laboratorium in te richten ontbrak. ‘Het is natuurlijk dat prof Mees, voor wien door Deutgen alles in orde gemaakt en bijeen gescharreld wordt, weinig daarvan merkt, en weinig noodzaak ziet daarin verandering te brengen,’ schreef Heike. Mees was welwillend en voorkomend, maar had weinig behoefte zich in het werk van anderen te verdiepen, zeker als het niet af was. Toch stond Heike in Groningen niet alleen in zijn belangstelling voor de kinetische gastheorie. Conrad Mensinga, die een jaar later met zijn natuurkundestudie was begonnen en al in 1875 doctoraalexamen deed, koos als | |
[pagina 90]
| |
promotieonderwerp de warmtegeleiding in gassen. Het proefschrift, verdedigd op 8 september 1877, gaf een overzicht van het theoretisch werk van Clausius, Maxwell en anderen, en besprak de experimentele bepalingen op het gebied van de warmtegeleiding sinds Rumford (die op het eind van de achttiende eeuw stelde dat warmte in gassen alleen via stroming is te transporteren). Eigen theoretische inzichten had Mensinga niet te bieden, en zijn experimentele bijdrage aan het vraagstuk beperkte zich tot het herhalen van proeven met ‘gloeiingsverschijnselen’ in buisjes met gas die rond 1850 door Grove en Magnus waren uitgevoerd.Ga naar eind40 Dat nam niet weg dat Heike in studiemakker Conrad (die na zijn promotie hbs-leraar werd) iemand had met wie hij over kinetische gastheorie kon praten. De belangstelling van Mees, die in 1876 series proeven naar de samendrukbaarheid van water op touw zetteGa naar eind41 en twee jaar later de theorieën achter de radiometer van Crookes (een molentje in een gedeeltelijk vacuüm gezogen buis met fragiele ‘wieken’ die aan één kant zwart zijn draait als er licht op valt) aan een kritisch onderzoek onderwierp,Ga naar eind42 kwam voor Heike waarschijnlijk te laat. Op 6 juni 1876 haalde Heike, 22 jaar oud, zijn doctoraalexamen ‘met den eersten graad’. Eerder dat jaar was eindelijk het Organiek Besluit uit 1815 vervangen door een nieuwe wet op het hoger onderwijs (zie het volgende hoofdstuk) maar Heikes afstuderen verliep nog volgens de oude regeling. Het ‘doctoraal-examen a’, bedoeld voor wie in wis-, natuur- of sterrenkunde wilde promoveren, omvatte de vakken wiskunde, mechanica, mathematische fysica en ‘theoretische astronomie’. Kosten: ƒ 64. De student moest vraagstukken oplossen die hij de dag tevoren onder ogen had gekregen. Ook diende hij aan te tonen de colleges metafysica en geschiedenis der oude filosofie, in Groningen verzorgd door Van der Wijck, ‘met vrucht’ te hebben bijgewoond. Aan bod kwamen vooral Duitse filosofen: Fichte, Kant, Hegel, Jacobi, Schelling en Goethe.Ga naar eind43 Volgens het Organiek Besluit omvatte het doctoraalexamen ook biologie en toegepaste scheikunde, maar sinds jaar en dag verleende de minister standaard vrijstellingen voor die vakken. Heike vroeg ze aan op 2 juni 1875, wat zou kunnen betekenen dat hij eigenlijk eerder had willen afstuderen.Ga naar eind44 De eisen die hij zich stelde, zijn vaste voornemen om op Mees, die hij zeer hoogschatte, een goede indruk te maken en zijn ambitie om - in tegenstelling tot Conrad Mensinga - in het vak door te gaan, zouden hem ertoe verleid kunnen hebben het examen een jaartje uit te stellen. Er was nog een reden: het studiejaar 1875-1876 was Heike Kamerlingh Onnes rector van de senaat van Vindicat atque Polit. |
|

