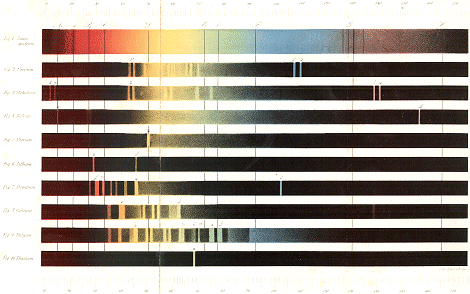Vaderlandsche letteroefeningen. Jaargang 1865
(1865)– [tijdschrift] Vaderlandsche Letteroefeningen–
[pagina 224]
| |
De spectraal-analyse.
| |
[pagina 225]
| |
moeten wij enkele punten uit de geschiedenis der Optica in herinnering brengen. Newton, de groote Engelsche natuuronderzoeker, ontdekte in het begin der zeventiende eeuw, dat, wanneer men zonlicht op een prisma laat vallen, dit licht, na door het prisma te zijn heengegaan, gescheiden is in eene reeks van kleuren, waarvan hij er zeven onderscheidde. Het gekleurde lichtbeeld van het aldus door een prisma opgevangen zonlicht noemde hij zonnespectrum; en de zeven door hem daarin onderscheiden kleuren zijn de bekende kleuren van den regenboog: rood, oranje, geel, groen, blaauw, indigo of donkerblaauw, en violet. Deze onderscheiding in zeven kleuren is echter kunstmatig; die kleuren toch zijn in het spectrum van het zonlicht niet scherp gescheiden, maar gaan ongemerkt in elkander over, zoodat het aantal kleuren, in het zonnespectrum voorkomend, oneindig groot kan genoemd worden. Rood en oranje zijn twee hoofdkleuren, maar daar tusschen bevinden zich alle mogelijke overgangen; evenzoo tusschen oranje en geel, tusschen geel en groen, enz. Eerst in het begin der negentiende eeuw werd de kennis van het zonnespectrum, zoo als die door Newton aan het licht was gebragt, verder uitgebreid. In 1802 namelijk ontdekte Wollaston, dat het zuivere zonnespectrum geen onafgebroken geheel uitmaakt, maar door vijf donkere dwarslijnen doorsneden wordt. Deze ontdekking van Wollaston wekte evenwel in den beginne weinig belangstelling, zoo weinig zelfs, dat zij twaalf jaren later in Duitschland nog niet bekend was. Onafhankelijk van Wollaston werd dezelfde ontdekking in 1814 door Fraunhofer gedaan, die, in het bezit van meer volmaakte hulpmiddelen, welke hij zelf in zijne beroemde fabriek van optische instrumenten vervaardigde, in staat was het zonnespectrum veel naauwkeuriger te bestuderen dan Wollaston. Fraunhofer ontdekte dan ook, dat het aantal dier donkere dwarslijnen of strepen in het zonnespectrum zeer groot is; hij telde er ongeveer 600. Naar hem worden deze donkere strepen in het zonnespectrum gewoonlijk de Fraunhofersche strepen genoemd. Zij zijn op eene schijnbaar onregelmatige wijze over het geheele spectrum verspreid; sommige zijn meer, andere minder in het oog vallend; de meest in het oog vallende duidde hij aan met de letters A, B.....H, terwijl hij ter onderscheiding van enkele strepen de letters a, b koos. Op de hier achter volgende plaat, fig. 1, vindt men eene | |
[pagina 226]
| |
afbeelding van het zonnespectrum, met de voornaamste der Fraunhofersche strepen. Latere onderzoekingen hebben geleerd, dat het aantal dezer donkere strepen nog veel grooter is dan door Fraunhofer was aangegeven. Brewster telde er ruim 2000. En Kirchhoff, wiens naam aan de spectraal-analyse onafscheidelijk verbonden is, en die een toestel gebruikte, waarbij vier prisma's achter elkander waren geplaatst, zoodat het spectrum eene zeer groote uitgebreidheid verkreeg, vond het aantal dezer donkere strepen nog veel grooter. In den allerlaatsten tijd heeft men getracht het zonnespectrum nog uitgebreider te maken, door het aantal achter elkander geplaatste prisma's te vermeerderen (Gassiot plaatste er zelfs negen achter elkander), en naarmate men nu meer prisma's gebruikte, vond men, onder overigens gelijke omstandigheden, ook een grooter aantal dezer donkere strepen. Ziedaar in het kort de voornaamste feiten aangegeven uit de geschiedenis van het zonnespectrum, voor zoover die betrekking hebben op ons tegenwoordig onderwerp. Wij lieten ze vooraf gaan, omdat wij ze later zullen gebruiken, wanneer wij spreken over hetgeen de spectraal-analyse ten opzigte van de zamenstelling der zon geleerd heeft. Thans gaan wij over tot de schoone ontdekkingen, waarmeê Kirchhoff en Bunsen, de uitvinders der spectraal-analyse, zijn aangevangen. Het was reeds lang bekend, dat sommige stoffen de eigenschap bezitten, om, wanneer zij in eene vlam gebragt worden, die op zich zelve ongekleurd is, aan die vlam de eene of andere kleur mede te deelen. Alkohol b.v. brandt met eene bleek blaauwe vlam; maar brengt men in de alkoholvlam een weinig soda, zoo wordt zij geel van kleur. Even zoo kleurt strontiaan de alkoholvlam en iedere andere kleurlooze vlam rood, potasch violet, boorzuur groen, enz. Dit alles was reeds lang bekend, en die kleuren, aan de vlam medegedeeld, konden aangewend worden om sommige stoffen van elkander te onderscheiden. Door verschillende personen waren deze gekleurde vlammen ook reeds met het prisma ontleed, en daarbij had men opgemerkt, dat de verkregen spectra meestal uit afwisselend lichte en donkere gedeelten bestonden van verschillende breedte. Wij noemen hier slechts de namen van Brewster, Talbot, Herschel, Miller, Swan en Van der Willigen. Maar niemand kwam op de gedachte, om de spectra dezer gekleurde vlammen naauwkeurig te onderzoeken en de be- | |
[pagina 227]
| |
kende zaken toe te passen op de praktijk. Dit geschiedde eerst door twee Heidelbergsche professoren, Kirchhoff en Bunsen, en het is aan hunne uitvoerige en geniale onderzoekingen, dat de spectraal-analyse haar ontstaan te danken heeft. Brengt men in eene vlam, die op zich zelve slechts uiterst weinig licht geeft, en daarom eene kleurlooze vlam kan genoemd wordenGa naar voetnoot1), een weinig soda, hetgeen het best aan een dunnen platinadraad geschiedt, die tot een oog is omgebogen, dan wordt de vlam, zoo als wij reeds zeiden, daardoor geel gekleurd. Onderzoekt men nu dit gele licht met een prisma, en wel op zoodanige wijze, dat men het licht door eene naauwe spleet laat gaan, waarachter het prisma geplaatst isGa naar voetnoot2), dan verkrijgt men een zeer eigenaardig spectrum. Men ziet nu niet, zoo als bij aanwending van zonlicht, een spectrum, dat alle kleuren bevat, maar men ziet slechts ééne gele streep, waarvan de breedte afhankelijk is van de breedte der spleet, die door de vlam verlicht wordt: hoe breeder spleet, des te breeder is ook de gele streep, en omgekeerd. Verwijdert men de soda weder uit de vlam, zoo verdwijnt ook de gele streep, en men ziet nagenoeg niets. Die gele streep wordt nu in het spectrum te voorschijn geroepen niet alleen door zuivere soda, maar ook door verbindingen daarvan, b.v. door zwavelzure soda, door salpeterzure soda, ook door chloorsodium, enz.; die gele streep, die altijd volmaakt op dezelfde plaats in het spectrum optreedt, is derhalve karakteristiek voor de soda, of liever voor het daarin bevatte metaal, het sodium of natrium. De plaats dezer karakteristieke streep is aangegeven op onze plaat, fig. 5. - Brengt men nu, in plaats van soda, zuivere potasch in de kleurlooze vlam, en onderzoekt men het licht dezer vlam, die nu door de potasch eene violette kleur verkregen heeft, weder met het prisma, | |
[pagina 228]
| |
dan ziet men geheel iets anders; men verkrijgt nu een spectrum, waarin de meeste kleuren voorkomen, doch waarin tevens twee eigenaardige helle strepen worden aangetroffen, namelijk ééne roode, en ééne violette. Dit spectrum, door potasch voortgebragt, ziet men weder op volkomen dezelfde wijze wanneer men deze of gene verbinding van potasch, of in het algemeen van het metaal potassium (ook kalium genoemd), in de vlam brengt. Het bedoelde spectrum, met de eigenaardige roode en violette strepen, is alzoo karakteristiek voor het kalium; het is afgebeeld op de plaat, fig. 4. Ziedaar reeds een paar feiten, door Kirchhoff en Bunsen aan het licht gebragt. Maar hunne onderzoekingen omvatten nog veel meer. Op dezelfde wijze als voor soda en potasch gingen zij ook de spectra na, die andere stoffen bij verhitting in eene kleurlooze vlam geven, en wel bepaaldelijk lithia, kalk, strontiaan en baryt. Zij vonden ook bij deze vier stoffen, dat het onverschillig is of men deze stoffen zelve, dan wel de eene of andere harer verbindingen in de vlam brengt: het spectrum blijft, voor ieder dezer stoffen, steeds hetzelfde. Deze spectra werden met groote zorg en naauwkeurigheid door hen in teekening gebragt, en zijn op onze plaat weêrgegeven, fig. 6-9. Het zal naauwelijks noodig zijn hier te herinneren, dat lithium het metaal is, dat in de lithia voorkomt, calcium het metaal van de kalk, strontium dat van de strontiaan, baryum dat van de baryt. In elk dier spectra komen eigenaardige strepen voor, die karakteristiek zijn voor iedere stof. De helste dier strepen zijn door Kirchhoff en Bunsen benoemd met de eerste letters van het Grieksche alphabet. Zoo noemden zij de roode streep van de potasch α, de minder in het oog vallende violette streep β. Het spectrum van lithia bestaat uit twee scherp begrensde strepen, eene prachtig roode, die zij χ noemden, en eene zeer flaauwe oranje, door β aangeduid (men zie de letters op de plaat). Het spectrum, dat kalk en kalkverbindingen geven, bevat meerdere strepen, waarvan echter twee bijzonder in het oog vallend zijn, namelijk eene breede roode (α) en eene breede groene (β). Bij strontiaan vindt men voornamelijk strepen in het rood en oranje, waarvan de drie helste door α, β, γ zijn aangeduid; bijzonder in het oog vallend is de breede oranje streep α, terwijl ook de blaauwe streep δ zeer eigenaardig is voor dit lichaam. Bij baryt eindelijk is het spectrum tamelijk zamengesteld; het bevat eenige flaauwe strepen | |
[pagina 229]
| |
in het rood, oranje en geel, en verscheidene zeer helle in het groen, van welke vooral α en β in het oog vallen. De vraag ligt hier voor de hand, of ook niet andere stoffen dan de zes genoemde, wanneer zij in eene vlam verhit worden, strepen in het spectrum te voorschijn doen treden; of zulks bij voorbeeld ook niet het geval is met ijzer, koper, lood, enz. of verbindingen dezer metalen. Op dit punt komen wij later terug; voor het oogenblik zij het hier genoeg op te merken, dat, behalve de zes genoemde lichamen (potasch, soda, lithia, kalk, strontiaan en baryt) er slechts nog zeer weinige zijn, die bij verhitting in eene vlam strepen in het spectrum geven. De reden daarvan is hierin gelegen, dat die zes stoffen in eene gewone gasvlam gemakkelijk vervlugtigd worden, terwijl die vlam niet heet genoeg is om de meeste zware metalen of hunne verbindingen in dampvorm te doen overgaan. En verdamping is voor elk lichaam een vereischte, om zijne eigenaardige strepen in het spectrum te doen optreden. Verhit men de zware metalen of hunne verbindingen sterk genoeg, dan geven ook deze eigenaardige strepen. Later zullen wij zien op welke wijze zulke eene sterker verhitting dan in eene gewone gasvlam mogelijk is, kan verkregen worden. - Vooreerst bepalen wij ons bij die lichamen, welke, bij verhitting in zulk eene vlam, vervlugtigd worden en dus strepen kunnen geven in het spectrum; en tot deze behooren de zes, wier spectra wij beschreven hebben. Uit het zoo straks gezegde blijkt, dat elk dier zes lichamen een geheel verschillend spectrum geeft. Hiervan is door Kirchhoff en Bunsen dadelijk toepassing gemaakt, en wel op de volgende wijze. Soda, in de vlam gebragt, geeft in het spectrum de straks besproken gele streep; wel nu, daar er geen ander lichaam bekend is, dat bij verhitting in de vlam diezelfde gele streep, op dezelfde plaats, in het spectrum voortbrengt, zoo kan men die gele streep als herkennings-middel voor de soda gebruiken. Brengt men een onbekend lichaam in de kleurlooze vlam en ziet men in het spectrum die gele streep, zoo is het lichaam soda of bevat ten minste soda; ziet men de gele streep niet, zoo is het iets anders dan soda. Ziet men in het spectrum van het onbekende lichaam eene roode streep op dezelfde plaats waar de streep α van het kalium op de afbeelding voorkomt, zoo is of bevat het lichaam potasch. En zoo verder. Ziedaar derhalve de prismatische ontleding der gekleurde vlam- | |
[pagina 230]
| |
men toegepast op de praktijk: ziedaar de spectraal-analyse in het leven geroepen! Om evenwel een duidelijk begrip te verkrijgen van de hooge waarde en voortreffelijkheid van dit nieuwe middel van onderzoek, moet men nog letten op de volgende zaken. Kirchhoff en Bunsen toonden aan, dat, wanneer men twee stoffen te gelijk in de vlam brengt, men in het spectrum de strepen van die beide stoffen te gelijk ziet; brengt men er drie in de vlam, dan ziet men in het spectrum de strepen van die drie te gelijk; brengt men ze alle zes gelijktijdig in de vlam, zoo ziet men ook de strepen van alle zes, gelijktijdig of zeer kort na elkander. Dit feit nu is voor de praktijk van hooge waarde. Immers zoo men nu een mengsel van eenige dezer stoffen heeft, behoeft men slechts een weinig van dit mengsel in de vlam te brengen en het spectrum waar te nemen: oogenblikkelijk geeft iedere stof hare eigene strepen, en in weinige sekonden heeft men door middel van die strepen bepaald welke stoffen aanwezig zijn, en welke niet. - De spectraal-analyse biedt alzoo het middel aan, om de zes genoemde stoffen met zeer weinig moeite en in zeer korten tijd op te sporen of aan te toonen, terwijl bij aanwending der vroegere scheikundige hulpmiddelen daartoe meestal verscheidene langwijlige bewerkingen vereischt worden. Maar de voortreffelijkheid van het nieuwe onderzoekingsmiddel valt nog meer in het oog, wanneer men let op zijne gevoeligheid, dat is op de uiterst kleine hoeveelheden stof, die voldoende zijn, om in het spectrum de karakteristieke strepen te voorschijn te roepen. Drukt men die kleinste benoodigde hoeveelheden in getallen uit, dan komt men tot cijfers, die ons inderdaad bewondering afpersen. Kirchhoff en Bunsen hebben die kleinste hoeveelheden bij benadering bepaald, en ofschoon de door hen opgegeven grootheden verbazend klein zijn, zijn zij naar onze overtuiging nog veel te groot. Zij bepaalden die hoeveelheden door b.v. eene zeer kleine afgewogene hoeveelheid chloorzure soda, met melksuiker vermengd, te doen ontploffen, waarbij de soda in zeer fijn verdeelden toestand, als stof, in de lucht verspreid wordt. Uit den bekenden inhoud van het vertrek en de bekende hoeveelheid lucht, die in een zekeren tijd met de vlam in aanraking komt, berekenden zij de hoeveelheid soda, die in ééne sekonde door de lucht in de vlam werd gevoerd. En | |
[pagina 231]
| |
op dergelijke wijzen gingen zij ook bij de overige lichamen te werk. Zij vonden nu op deze wijze, dat, door middel van de gele streep in het spectrum, van soda nog één drie-duizend-millioenste deel van een wigtje zeer duidelijk kan worden aangetoond. Inderdaad eene hoeveelheid die zoo klein is, dat men er zich geen denkbeeld van vormen kan! Bedenken wij dat eene hoeveelheid, die honderd duizend maal grooter is, slechts ter naauwernood door de allergevoeligste balansen kan worden aangewezen! - Voor andere stoffen gaat de gevoeligheid wel niet zóó ver als voor de soda, maar zij is toch ook voor deze verbazend groot. Van kalk is b.v. slechts één twintig-millioenste, van lithia slechts één honderd-millioenste deel van een wigtje noodig. Letten wij op deze ontzettend kleine hoeveelheden, die door de spectraal-analyse nog aangetoond kunnen worden, dan kan het ons niet verwonderen, dat deze sommige stoffen heeft aangetoond in lichamen, waarin ze vroeger niet waren vermoed. Van potasch, soda en kalk was het reeds bekend, dat zij in de natuur zeer algemeen verspreid zijn; maar lithia, strontiaan en baryt waren tot dusverre slechts in een betrekkelijk zeer klein aantal mineralen en in enkele minerale wateren aangetroffen. De spectraal-analyse heeft geleerd, dat ook deze tot de zeer algemeen verbreide stoffen behooren. In het zeewater b.v. had men vroeger, zelfs bij verdamping van zeer groote hoeveelheden, noch lithia, noch strontiaan kunnen aantoonen: thans zijn weinige droppels voldoende, om het aanwezen van deze beide stoffen in het water van den oceaan te bewijzen. In een tal van mineralen heeft men lithia, strontiaan en baryt gevonden, en zoo ook lithia en strontiaan in de asch van planten, in minerale en wel-wateren enz. Alle welwateren b.v. die in ons vaderland worden aangetroffen, bevatten zoowel lithia als strontiaan: - en voor weinige jaren werden deze beide stoffen nog onder de uiterst zeldzaam voorkomende gerekend. De straks genoemde kleine grootheden verklaren ons verder, dat men ook in de dampkringslucht zoo gemakkelijk sporen van deze of gene stof kan aantoonen, en vooral geldt dit van de soda. Soda kan alleen in den dampkring voorkomen in kleine, in de lucht zwevende vaste deeltjes, het stof, dat, wanneer de lucht in rust is, voor het grootste deel op andere voorwerpen neêrvalt. En toch gelukte het ons nooit, zelfs in een ruim vertrek, dat vele dagen achtereen geheel gesloten was geweest, eene | |
[pagina 232]
| |
gasvlam, die vrij in dat vertrek brandde, geheel vrij van soda te zien. Wordt in een dergelijk vertrek het neêrgevallen stof weder in de lucht verdeeld, b.v. door den grond te vegen, dan komt na weinige oogenblikken de gele streep van het sodium buitengewoon sterk te voorschijn, om eerst een geruimen tijd later, wanneer het stof op nieuw bezinkt, weder te verflaauwen. Even zoo wordt die gele streep zeer sterk zigtbaar, wanneer men een boek of een kleedingstuk op eenigen afstand van de vlam uitklopt; een platinadraad, die met de grootste zorg van alle sporen van soda is bevrijd, is op nieuw daarmede bedeeld, wanneer hij slechts eenige uren aan de lucht is blootgesteld geweest. Overal zweven stofjes in den dampkring; overal vindt men de soda, in die stofjes vervat! Ten opzigte van dit algemeen voorkomen der soda in het stof van den dampkring is onlangs eene zeer merkwaardige proef genomen door onzen landgenoot Dr. E. Mulder, van welke wij alleen het resultaat willen vermelden. Hij toonde namelijk aan, dat die stofjes in de door den mensch uitgeademde lucht geheel ontbreken, ofschoon zij in de ingeademde lucht steeds voorkomen. Die stofjes worden alzoo door de longen, of door een ander deel der ademshalingswerktuigen, volkomen teruggehouden.
Wij gaan thans over tot de vermelding eener andere vrucht, die de spectraal-analyse reeds gedragen heeft. Wij bedoelen de ontdekking van vier nieuwe metalen. Reeds dadelijk na de ontdekking der nieuwe methode van onderzoek zagen Kirchhoff en Bunsen de mogelijkheid in, dat er op de aardkorst grondstoffen zouden voorkomen, die in geen enkellichaam, dat binnen ons bereik valt, zich in genoegzame hoeveelheid bevinden, om door de tot dus ver bekende hulpmiddelen der scheikunde te worden aangetoond, maar die misschien door de spectraalanalyse zouden kunnen worden opgespoord. Het eerste voorwerp, dat de beide Heidelbergsche professoren uit dit oogpunt onderzochten, was het minerale water van Dürckheim, en wel met bijzonder gelukkig gevolg. Nadat zij dit water aan zekere bewerkingen hadden onderworpen, en zij daardoor alle bekende stoffen, met uitzondering van potasch, soda en lithia, hadden verwijderd, onderzochten zij het overblijvende vocht met hun toestel, die ingerigt was voor de waarneming van het spectrum. Toen zij nu een weinig van deze vloeistof in de vlam bragten, zagen zij in | |
[pagina 233]
| |
het spectrum twee blaauwe streepen, die noch aan potasch, noch aan soda, noch aan lithia toebehoorden, en hun dus het aanwezen eener nog onbekende stof verraadden. Door verschillende bewerkingen, met groote scherpzinnigheid aangewend, gelukte het hun werkelijk dit nieuwe lichaam uit het Dürckheimer water af te zonderen. Ten bewijze van de geringe hoeveelheid waarin het in dit minerale water voorkomt, moge strekken, dat daarvan 44000 Ned. kannen verdampt werden en het overblijvende slechts zoo weinig van het nieuwe lichaam opleverde, dat Kirchhoff en Bunsen daaraan ter naauwernood de voornaamste eigenschappen bestuderen konden. - Intusschen, de spectraal-analyse had hare uitvinders eene nieuwe grondstof doen ontdekken, die een metaal bleek te zijn, zeer overeenkomstig met het metaal, dat in de potasch voorkomt (het potassium of kalium). Geheel eigenaardig is de naam, dien zij aan dit nieuwe metaal gaven; zij noemden het namelijk caesium, welk woord hemelsblaauw beteekent, naar de beide blaauwe strepen, die het in het spectrum te voorschijn brengt; die naam is tevens eene herinnering aan de geschiedenis zijner ontdekking. Later bleek het, dat in het spectrum van het caesium nog meerdere strepen worden aangetroffen, die echter veel flaauwer zijn dan de beide genoemde blaauwe; men vindt dit spectrum hierachter afgebeeld, in fig. 2; α en β zijn de twee strepen, die Kirchhoff en Bunsen het eerst waarnamen. Maar het bleef niet bij dit ééne nieuwe metaal. Nagenoeg gelijktijdig vonden zij, bij het onderzoek van een tamelijk zeldzaam mineraal, lepidolith geheeten, afkomstig uit Rozena in Bohemen, een tweede tot nog toe onbekend lichaam. Zij hadden ook hier weder eerst alle bekende stoffen, met uitzondering van potasch, soda en lithia, verwijderd, en zagen bij het overblijvende onbekende strepen in het spectrum, die noch aan potasch, noch aan soda, noch aan lithia, noch aan caesium toebehoorden, en dus weder eene nieuwe grondstof aanwezen. Het gelukte hun ook deze grondstof af te zonderen, die ook weder een metaal bleek te zijn van dezelfde groep, waartoe het potassium en het caesium behooren. Kirchhoff en Bunsen noemden het rubidium (afgeleid van rubidus, hetwelk donkerrood beteekent), omdat in zijn spectrum twee merkwaardige strepen voorkomen, die in het uiterste rood gelegen zijn; het geheele spectrum ziet men in fig. 3. Behalve de roode strepen γ en δ zijn ook de violette α en β zeer merkwaardig. | |
[pagina 234]
| |
Nog geen jaar was er na de bekendwording der schoone ontdekkingen van Kirchhoff en Bunsen verloopen, of een derde metaal werd door de spectraal-analyse ontdekt. Reeds zeer spoedig na die bekendwording hadden verschillende scheikundigen het nieuwe middel van onderzoek aangewend tot de ontleding van verschillende voorwerpen. Tot deze behoorde ook Crookes, een Engelschman, die onder andere zaken eene stof onderzocht, welke zich in eene zwavelzuur-fabriek had afgezet. Bij het inbrengen van die stof in de vlam zag hij in het spectrum eene groene streep, welke niet aan een bekend lichaam behoorde. Dit was in Maart 1861. Daardoor kwam hij op het vermoeden, dat die groene streep zou veroorzaakt worden door eene nog onbekende grondstof, welk vermoeden door zijne verdere onderzoekingen bevestigd werd. Uit het afzetsel in de zwavelzuur-fabriek gelukte het hem het nieuwe lichaam af te zonderen, waaraan hij, naar de groene streep in het spectrum, den naam gaf van thallium, afgeleid van het Grieksche woord ϑαλλος, dat groene spruit beteekent. Het spreekt van zelf, dat dit thallium af komstig moest zijn van de stoffen, welke in die zwavelzuur-fabriek bewerkt waren; en daar in die fabriek het zwavelzuur bereid werd uit zeker mineraal, ijzerkies geheeten, besloot hij tot het voorkomen van het thallium in dit mineraal. Het spectrum van het thallium bestaat uit slechts ééne streep, zoo als men ziet in fig. 10. Gelijk er ook in andere opzigten dikwijls naijver bestaat tusschen Engelschen en Franschen, zoo vertoonde die zich weldra ook bij de ontdekking van dit nieuwe metaal. Vijftien maanden namelijk nadat Crookes de eerste mededeelingen omtrent het nieuwe metaal had bekend gemaakt, kwam in Frankrijk Lamy voor de tweede maal met de ontdekking van het thallium voor den dag (Junij 1862). Hij kende toen den arbeid van Crookes niet; maar ook nadat hij daarvan kennis bekomen had, bleef hij zich zelven geheel en al de eer der ontdekking toekennen. Natuurlijk kwamen niet alleen Crookes, maar ook andere Engelsche scheikundigen hiertegen op, terwijl aan den anderen kant de partij van Lamy door verscheidene Fransche scheikundigen, onder anderen door den bekenden Dumas, getrokken werd. En zoo ontstond er een strijd over de eer der ontdekking, waarbij aan de Fransche zijde waarheid niet altijd op den voorgrond stond, en waarbij de Franschen soms bewezen feiten stoutweg ontkenden. | |
[pagina t.o. 234]
| |
| |
[pagina 235]
| |
Maar die strijd kon niet lang duren: de waarheid moest zegevieren, zoodat dan ook thans Crookes algemeen als de ontdekker van het thallium erkend wordt. - Deze eer komt echter aan Lamy toe, dat hij zich door zijne onderzoekingen omtrent het thallium zeer verdienstelijk heeft gemaakt. Hij was tot die onderzoekingen in staat gesteld, doordien zijn schoonvader eene zwavelzuur-fabriek bezat, waarin zich, even als bij de straks genoemde Engelsche fabriek, eene thallium-houdende stof afzette, zoodat hij van die stof zeer gemakkelijk ruime hoeveelheden kon verkrijgen. Zelfs was hij door die familie-omstandigheid in staat de fabriek zoodanig te laten inrigten, dat het thallium daarin zooveel mogelijk in eene kleine ruimte werd bijeen verzameld, wat aan zijne verdienstelijke onderzoekingen niet weinig bevorderlijk was. Wij komen thans tot de geschiedenis van het vierde metaal, dat door de spectraal-analyse werd ontdekt. Hierover kunnen wij echter zeer kort zijn, omdat van dit vierde metaal nog zoo weinig bekend is. Het werd in het vorige jaar ontdekt door twee Duitsche scheikundigen, Reich en Richter, te Freiberg in Saksen, in een mineraal, hetwelk de ertsen van lood en verschillende andere metalen bevatte. Zij werden tot die ontdekking geleid door de waarneming eener nog onbekende blaauwe streep in het spectrum. Naar die blaauwe streep hebben zij aan het nieuwe metaal den naam van indium gegeven. Met verlangen worden de verdere onderzoekingen van Reich en Richter tegemoet gezien. Vier metalen alzoo werden tot op dit oogenblik reeds door middel der spectraal-analyse ontdekt; en de mogelijkheid bestaat, dat er op deze wijze, vroeger of later, nog meerdere ontdekt worden. Doch de spectraal-analyse was niet alleen het middel tot ontdekking dezer vier nieuwe lichamen; zij toonde ook aan, dat althans sommige daarvan zeer algemeen verbreid in de natuur voorkomen. Caesium en rubidium werden door Kirchhoff en Bunsen gelijk ook door andere scheikundigen, met behulp der karakteristieke strepen in het spectrum, in zeer verschillende mineralen en in vele minerale wateren aangetoond. Het rubidium bleek daarbij nog algemeener voor te komen dan het caesium; eerstgenoemd lichaam (het rubidium) werd daarenboven in zeer verschillende planten aangetroffen, terwijl het caesium daarin tot nog toe niet is gevonden. Rubidium werd b.v. door Grandeau aangetoond in de asch van beetwortelen, in tabak van zeer verschillende groeiplaatsen, in koffij, in thee en in druivensap, | |
[pagina 236]
| |
terwijl het suikerriet en de cacao (dus ook de chocolade) daarvan vrij bleken te zijn. Door anderen werd rubidium nog in de asch van verschillende houtsoorten aangetoond. Er blijkt genoeg uit, dat vooral het rubidium, ofschoon het tot nog toe nergens in aanzienlijke hoeveelheden is aangetroffen, tot de meest verbreide stoffen in de natuur behoort. Van het thallium is het mede gebleken, dat het in verschillende mineralen voorkomt. Van het indium is, zoo als wij boven reeds meldden, nog te weinig bekend om er in dit opzigt iets van te zeggen. Maar wij hooren sommigen onzer lezers reeds vragen: waartoe dienen nu die vier nieuwe metalen? welk nut brengen zij aan? kunnen zij tot het een of ander doel worden aangewend? - Wanneer de laatste vraag alleen uit een technisch of industrieel oogpunt gedaan wordt, is het antwoord daarop ontkenkend. Eene regtstreeksche toepassing voor het dagelijksch leven is nog van geen dezer vier metalen gemaakt. Doch wij hebben hier twee opmerkingen. In de eerste plaats vraagt de wetenschap niet dadelijk naar het nut; elke nieuwe waarheid, elk nieuw gevonden feit is voor haar van waarde, onverschillig of de fabriekant of de kunstenaar het terstond kan gebruiken. Maar in de tweede plaats heeft de geschiedenis geleerd, dat zoo menigmaal reeds nieuwe grondstoffen ontdekt zijn, wier bestaan langen tijd alleen voor de wetenschap waarde had, terwijl soms vele jaren later de industrie ze tot verschillende nuttige doeleinden ging aanwenden. Toen b.v. Malard in 1826 in het zeewater het bromium ontdekt had, was dit lichaam, eene uiterst stinkende en vergiftige vloeistof, alleen voor de scheikundigen van eenig belang; - en thans wordt het, in verbinding met andere stoffen, dagelijks door elken photograaph in handen genomen: zonder bromium zou de photographie nimmer hare tegenwoordige hoogte bereikt hebben. Men onttrekke dus zijne belangstelling aan eenig lichaam niet, omdat er geen dadelijk gebruik van gemaakt wordt. Met een enkel woord over de eigenschappen der nieuwe metalen, willen wij van deze afscheid nemen. Het caesium en het rubidium vertoonen onderling veel overeenkomst; zij behooren beide tot dezelfde groep van metalen, waartoe ook het potassium en het sodium (de metalen van de potasch en de soda) behooren. Vooral met het potassium komen zij in eigenschappen zeer overeen. Zij kunnen geen van beide aan de lucht worden blootge- | |
[pagina 237]
| |
steld, zonder zich met de zuurstof der lucht te verbinden; eene directe toepassing voor het dagelijksch leven laat zich van hen niet verwachten. Wat hunne verbindingen misschien nog een maal voor ons zijn zullen, is onbekend; men denke aan de geschiedenis van het bromium! - Het thallium bezit geheel andere eigenschappen. Aan de lucht blootgesteld, verandert het bijna niet; uiterlijk heeft het groote overeenkomst met lood. Van dien kant zou dus aanwending in het dagelijksch leven niet onmogelijk zijn; maar tot nog toe wordt het daarvoor veel te spaarzaam gevonden. Voor de schei- en natuurkunde is het reeds thans een gewigtig lichaam, onder anderen wegens zijne eigenschap van aan kleurlooze vlammen eene groene kleur mede te deelen. Eindelijk, het thallium behoort tot de vergiftige stoffen, en ook hierin komt het geheel met het lood overeen.
Wij zagen alzoo, dat de spectraal-analyse aan de scheikunde een zeer gewigtig hulpmiddel tot onderzoek heeft geschonken: een hulpmiddel, dat in weinige minuten doet vinden, wat vroeger soms niet dan ten koste van even zoo vele dagen arbeidens opgespoord kon worden; een hulpmiddel, dat niet alleen in snelheid van uitvoering, maar ook in gevoeligheid alle vroegere verre achter zieh laat, zoodat thans hoeveelheden van stoffen kunnen aangetoond worden, van wier kleinheid men zich geen denkbeeld vormen kan. Wij zagen ook, dat de spectraal-analyse reeds verscheidene nieuwe grondstoffen heeft doen ontdekken en welligt het middel kan zijn om er nog meerdere aan het licht te brengen. Intusschen, dit alles heeft nog slechts betrekking op de aarde en aardsche voorwerpen; maar ook voor onze kennis van voorwerpen buiten de aarde, is de ontdekking van Kirchhoff en Bunsen van het hoogst belang. Wat zij ons daaromtrent reeds geleerd heeft zullen wij in het volgend gedeelte van dit opstel zien. |
|