Nederlandsche helden der wetenschap
(1946)–T.P. Sevensma–Levensschetsen van negen Nobelprijswinnaars. Hoogtepunten van wetenschappelijken arbeid in Nederland
[pagina 11]
| |
door Dr. J. van Alphen
| |
[pagina 12]
| |
meester, ten einde de traditie niet te verbreken, dat een van 't Hoff dit ambt in het dorp Groote Lind bekleedde. Echter werd besloten, mede op raad van de leeraars van de particuliere school, die hij bezocht, dat hij voorloopig naar de Hoogere Burgerschool zou gaan, een inrichting van onderwijs, kort te voren door den minister Thorbecke in het leven geroepen. In September 1867 deed van 't Hoff examen voor de vierde klasse en hij slaagde, zij het dan ook met een herexamen voor Fransch; hij is niet de eerste en ook niet de laatste in den lande geweest, die over deze taal gestruikeld is. Op de H.B.S. maakte Henry voor het eerst kennis met de chemie en dit vak bekoorde hem zoo, dat hij dikwijls met twee gelijkgezinde kameraden op Zondagochtend in het schoolgebouw sloop om scheikundige proeven uit te voeren. Nu is voor een jongen de chemie gewoonlijk ‘dat wat knalt en stinkt’ en het is dus te begrijpen, dat de directeur van de school, toen hem dit via den portier ter oore kwam, doodsbang voor een brand, de zaak oogenblikkelijk ten strengste verbood. Te meer was dit verbod gerechtvaardigd, daar de jonge experimentatoren een geprononceerde voorliefde aan de dag bleken te leggen voor het uiterst vergiftige blauwzuur. Dus moesten de proeven thuis worden voortgezet; ouders en vrienden werden tot bijwoning der voorstellingen uitgenoodigd, maar tegen betaling! Op deze wijze werd een fonds verkregen, waaruit nieuwe demonstraties betaald konden worden. Het eindexamen-diploma werd op 7 Augustus 1867 verworven en uit de cijferlijst, die als volgt luidde: wiskunde en mechanica: uitstekend natuurwetenschappen: zeer goed geschiedenis, staats- en handelswetenschappen: goed talen: voldoende teekenen: voldoende blijkt duidelijk, dat de aanleg van Van 't Hoff naar de kant van de exacte wetenschappen (wiskunde en natuurwetenschappen) lag. De aangewezen weg was dus, dat hij de Polytechnische School te Delft (de tegenwoordige Technische Hoogeschool) zou bezoeken en na de groote vacantie woont hij in deze stad op kamers en is hij hard aan de studie getrokken. De bedoeling is, dat hij de wetenschap zal bestudeeren, die de scheikunde in de techniek toepast, de technologie, maar spoedig lijkt hem de techniek tusschenbeide zeer | |
[pagina 13]
| |
eentonig. Tot bewustzijn komt hem dit na zijn eerste zomervacantie, waarin hij de campagne aan een suikerfabriek in Noordbrabant meemaakt. Zijn phantasie trekt hem naar de zuivere wetenschap, die gediend wordt om haar zelver wille. Gesprekken met zijn ouders volgen en ofschoon wij er niet bij geweest zijn, kunnen wij ons toch volkomen voorstellen, hoe die gesprekken verloopen zijn. Henry zal met enthousiasme zijn meening verkondigd hebben, dat alleen de zuivere wetenschap het ideaal moet zijn, waarnaar wij streven en dat het dagelijksch werk van den technoloog onmogelijk het gemoed kan bevredigen en dat men in die werkkring dus noodzakelijkerwijze diep ongelukkig moet worden. De vader zal een oude Latijnsche spreuk aangehaald hebben, welke zegt, dat men eerst moet zien te leven en dat men dan pas mag denken aan philosopheeren en dat met dat heele ideaal van de zuivere wetenschap maar een bijzonder klein stukje brood in Holland te verdienen valt en dat zoonlief wel anders zou praten, als hij net als zijn vader zeven kinderen te onderhouden had, wier maag met idealen niet gevuld kan worden. En de moeder zal getracht hebben te sussen en te bemiddelen en zooals in ieder Hollandsch huisgezin zal dat de moeder ook gelukt zijn. En zooals het hoort, de buitenwereld kwam alleen het bemiddelingsvoorstel te weten: Henry moest eerst zijn examen voor technoloog doen, dan had hij ten minste iets in het leven. Was dat goed afgeloopen, dan zou zijn wensch vervuld worden en mocht hij naar de Universiteit. | |
Studietijd.Henry trekt wild aan de studie, blokt en blokt en haalt op 8 Juli 1871 het vurig begeerde diploma van technoloog. Negentien jaar is hij oud; binnen twee jaar heeft hij het examen gehaald, terwijl zijn studiegenooten er drie jaar over doen, nu moet vader toch zijn belofte houden. En vader houdt zijn belofte; Henry mag naar Leiden! Maar om in Leiden te mogen studeeren, moet men Latijn en Grieksch kennen. Henry kent geen van beide en om dit bij te spijkeren zal zeker niet mee vallen, want talen zijn niet zijn sterkste vakken. Gelukkig wordt hem deze zware kwelling bespaard, want de minister van Binnenlandsche Zaken verleent dispensatie van de desbetreffende bepalingen op grond van het feit, dat bij de Tweede Kamer een wetsontwerp is ingediend, volgens welk ook studenten | |
[pagina 14]
| |
in het bezit van het einddiploma van de H.B.S. aan de Universiteiten examens zullen mogen afleggen in de geneeskundige en natuurwetenschappelijke vakken. Het zou dus zeker onbillijk zijn om de jonge Van 't Hoff voor het korte tijdsverloop tot de aanneming van deze wet de toegang tot de universitaire examens te weigeren. (Als merkwaardigheid zij vermeld, dat dit tijdsverloop tot 1917 geduurd heeft, toen de z.g. Wet Limburg aan de oud-H.B.S.ers dit recht schonk). In Leiden neemt Van 't Hoff een sterker aandeel aan het studentenleven dan hij in Delft had gedaan en vermeld staat, dat een tentamen mislukte ten gevolge van een voorafgegaan nogal vochtig feest. Zijn phantasie ontplooit zich en een sterke trek naar het romantische komt naar voren. De Engelsche dichter Lord Byron wordt zijn lievelingspoëet, wiens werk opengeslagen op zijn studeertafel ligt en dien hij telkens en telkens weer citeert. Ook zelf begint onze negentienjarige jongeling gedichten te schrijven en een bundel hiervan onderwerpt hij aan het oordeel van een ouderen vriend. Diens oordeel is dusdanig, dat Van 't Hoff besluit zich voortaan maar aan de chemie te wijden, welk besluit zijn studie ten goede komt, want binnen het jaar doet hij zijn candidaatsexamen. Maar de chemie, zooals zij in Leiden gedoceerd wordt, bevalt hem niet. Trouwens Leiden zelf bevalt hem niet, Leiden is luguber en vermolmd. Oog voor het schoone van deze oude Hollandsche stad heeft hij niet; hij will naar Bonn. In Leiden was alles proza, de omgeving, de stad, de menschen. In Bonn alles poëzie, schrijft hij later. In Bonn wàs alles poëzie. De omgeving, het prachtige Zevengebergte. De vroolijke studentenschaar en dan de leermeester der organische chemie bij wien hij werkt, de wereldberoemde August Kekulé, een man met een indrukwekkend uiterlijk. Maar in de natuur wordt het winter, in de kring zijner mede-studenten krijgt hij twist en zijn beroemde leermeester bekommert zich niet om hem! Zijn experimenteele vaardigheid blijkt niet bijzonder groot; ofschoon hij belangwekkende ontdekkingen verwacht, vindt hij eigenlijk niets en in het laboratorium maakt men zich vroolijk over zijn onhandigheid. Zijn ouders verlangen, dat hij eerst zijn examen doet en hij reist in Juni 1873 naar huis, gewapend met een prachtig, maar niet geheel met de waarheid overeenstemmend getuigschrift van Kekulé. Hij laat zich aan de Universiteit te Utrecht inschrijven en na | |
[pagina 15]
| |
drie maanden, in December 1873 legt hij het doctoraal examen af. Kekulé had hem bij het afscheid de raad gegeven, een groote universiteit te bezoeken en daarom ging Van 't Hoff naar Parijs om zijn studiën onder den niet minder beroemden Adolph Wurtz voort te zetten. In tegenstelling met in Bonn bemoeide hij zich hier nauwelijks met zijn mede-studenten en met slechts een enkele van hen maakte hij nader kennis, zoo b.v. met den vijf jaar ouderen Joseph Achille Le Bel uit Pechelbrunn in de Elzas. Echter zijn ouders hebben nog meer kinderen te onderhouden en het wordt tijd, dat Van 't Hoff zijn studie afsluit. In Juni 1874 komt hij dan ook reeds terug naar Holland, teneinde in Utrecht zijn dissertatie te bewerken en de doctorstitel te verwerven. | |
Eerste geschrift.Maar nog voor hij zich in de Domstad in laat schrijven, geeft hij op 22-jarige leeftijd in September 1874 zijn meest bekende geschrift uit, welks inhoud behandeld wordt over de geheele wereld in elke school, waar les in de scheikunde gegeven wordt. De Hollandsche titel is Hollandsch-zwaarwichtig en luidt: ‘Voorstel tot uitbreiding der tegenwoordig in de scheikunde gebruikte structuurformules in de ruimte, benevens een daarmee samenhangende opmerking omtrent het verband tusschen optisch actief vermogen en chemische constitutie van organische verbindingen’. Elf bladzijden telt deze brochure en de naam van den schrijver zoekt men tevergeefs op het titelblad; pas aan het eind wordt zij vermeld. Om de beteekenis van deze verhandeling naar waarde te kunnen schetsen, dient een uitgebreide inleiding over de organische chemie vooraf te gaan. De scheikunde houdt zich bezig met de bestudeering van de samenstelling der stoffen en de organische scheikunde meer in het bijzonder met die stoffen, welke alle koolstof, meestal ook waterstof, zuurstof of stikstof en soms nog andere elementen bevatten en waartoe ook bijna alle in het planten- of dierenrijk voorkomende stoffen behooren. Suikers, eiwitten, vetten zijn organische stoffen en dat deze verbindingen koolstof bevatten, blijkt oogenblikkelijk als men ze laat verkolen. Maar ook alcohol, azijnzuur, melkzuur (het zuur in de zure melk) en wijnsteenzuur (in zure wijn) zijn organische verbindingen. Tienduizenden van deze verbindingen waren reeds ontdekt en de | |
[pagina 16]
| |
chemici hadden een eigenaardig knikkerspel uitgevonden, waarmede zij de samenstelling van deze verbindingen konden verklaren en de mogelijkheid van het bestaan van nog niet ontdekte stoffen en zelfs hun eigenschappen konden voorspellen! Stoffen zijn n.l. opgebouwd uit moleculen, welke de kleinste deeltjes zijn, die nog de eigenschappen hebben van de stof zelf. Wel kan men de moleculen nog verder verdeelen in atomen, maar deze hebben niet meer de eigenschappen van de stof. Zoo kan men gewone suiker in steeds kleiner deeltjes verdeeld denken; ten slotte komt men echter bij een zoo klein deeltje, het molecule suiker, dat het, indien men het nog verder verdeelt, uiteenvalt in 12 deeltjes (atomen) koolstof, 22 deeltjes waterstof en 11 deeltjes zuurstof. Nu stelt men een atoom koolstof voor door C, een atoom waterstof door H en een atoom zuurstof door O en men zegt: de formule van suiker is C12H22O11. Zoo beteekent de formule C10H8 van naphthaline (uit welke stof gewoonlijk de z.g. kamferballetjes bestaan), dat een molecule naphthaline tien atomen koolstof en acht atomen waterstof bevat. Om dit te verduidelijken, willen wij een stof eens vergelijken met een leger. Een leger heeft bepaalde eigenschappen; het kan vechten marcheeren, eten enz. Het leger kunnen wij nu gaan verdeelen in regimenten, compagnies enz., die alle dezelfde eigenschappen hebben. Ten slotte komen wij bij deze verdeeling aan een kleinste deeltje, dat deze eigenschappen heeft, het molecule van het leger als het ware, den soldaat. Wel kunnen wij den soldaat nog verder verdeelen in armen, beenen, hoofd en romp, de atomen dus, maar deze hebben niet meer alle eigenschappen van het leger en zouden wij werkelijk de verdeeling uitvoeren, dan zouden de oorspronkelijke eigenschappen van het leger volkomen verloren gaan! Door het onderzoek van verschillende geleerden, in het bijzonder van August Kekulé, was gebleken, dat men een beeld kan krijgen van de samenhang der atomen in het molecule door het koolstofatoom voor te stellen als een bolletje met vier haakjes of op papier als zoodanig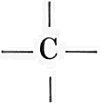 het waterstofatoom als een bolletje met een haakje H- en het | |
[pagina 17]
| |
zuurstofatoom als een bolletje met twee haakjes -O-. Om de ‘structuurformules’ van de stoffen te verkrijgen moet men dan de bolletjes in het juiste aantal zoodanig aan elkander haken, dat geen enkel haakje vrij blijft. Zoo zegt ons de structuurformule van de gewone alcohol: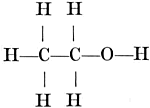 dat in het molecule twee koolstofatomen met elkander verbonden zijn. Een koolstofatoom is verbonden met drie waterstofatomen en het andere koolstofatoom met twee waterstofatomen en met een zuurstofatoom, dat zelf nog een waterstofatoom draagt. Maar, zal nu een scherp opmerker zeggen: het is nog mogelijk deze atomen op een andere wijze aan elkander te haken, zoo dat geen enkel haakje vrij blijft: 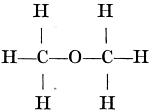 (andere wijzen van verbinding blijken niet mogelijk). Werkelijk is er nu nog een stof bekend, de dimethylaether, die ook 2 C, 6 H en een O atoom in het molecule bevat, maar die geheel verschilt van de aethylalcohol (zij is b.v. een gas en geen vloeistof) en aan welke op grond van haar eigenschappen laatstgenoemde formule moet worden toegeschreven. Het ideaal van de scheikundigen werd nu voor iedere stof één formule te vinden, die de samenstelling van de stof uitdrukt en bij iedere op papier mogelijke formule slechts één bijbehoorende verbinding te verkrijgen. Van het zuur uit de zure melk, het melkzuur, waren twee vormen bekend, die alleen daarin verschilden, dat de een het vlak van het gepolariseerd licht naar rechts en de ander naar links draaide. Gepolariseerd licht is licht, waarvan de trillingen in evenwijdige vlakken | |
[pagina 18]
| |
liggen, maar voor het volgende is het voldoende, als men weet, dat men dit licht kan verkrijgen door gewoon licht door een bepaald toestel, een polarisatie-apparaat te laten vallen. Brengt men in dit toestel een inactieve of niet-draaiende stof, dan ziet men het licht er gewoon door heen treden, brengt men er een z.g. rechtsdraaiende stof in, dan moet men het achterste gedeelte van het toestel over een bepaalde hoek met de wijzers van het uurwerk mee draaien om het licht op volle sterkte door te laten treden, terwijl het bij een linksdraaiende stof juist andersom is. Bijzonder was de aandacht op dit draaiend vermogen gevallen, omdat gebleken was, dat de stoffen, welke in het laboratorium bereid werden, inactief waren (voor zoover men hen niet uit een actieve stof had bereid), terwijl de belangrijkste stoffen uit de levende natuur, zooals eiwitten en suikers, wel links of rechts draaiden. Wislicenus onderzocht nauwkeurig de beide vormen van het melkzuur en hij kwam tot de pijnlijke conclusie, dat beide vormen voorgesteld moesten worden door één structuurformule: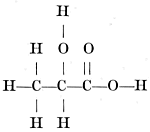 welke dus aanduidt, dat drie koolstofatomen met elkander verbonden zijn. Het eerste koolstofatoom draagt drie waterstofatomen, het tweede koolstofatoom een waterstofatoom en een met een waterstofatoom verbonden zuurstofatoom, terwijl het derde koolstofatoom een dubbel gebonden zuurstofatoom en een zuurstofatoom verbonden met een waterstofatoom draagt. Deze conclusie was zoo pijnlijk, omdat hiermede de lievelingsstelling van de chemici, met één formule stemt slechts één stof overeen, doorbroken was. En nu keeren wij tot onzen Van 't Hoff terug! Deze had de, wij zullen maar zeggen wanhopige verhandeling van Wislicenus gelezen, echter niet tot het eind, want halverwegen had hij de lectuur afgebroken en was hij door de mooie Utrechtsche dreven gaan wandelen. | |
[pagina 19]
| |
Hierbij steeg hem plotseling de idee op: Het koolstofatoom is geen bolletje met de vier valenties in het zelfde platte vlak haaks op elkander, maar het koolstofatoom is een viervlak, een tetraëder met de haakjes in de hoekpunten. Letten wij nu op het middelste koolstofatoom in het melkzuur, dan zien wij, dat het mogelijk is van melkzuur twee formules te geven, die elkaars spiegelbeeld zijn en alleen verschillen zooals linker- en rechterhand verschillen: 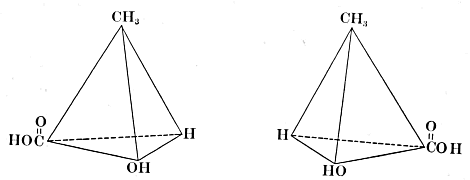 In deze formules is een zekere draaiing aanwezig, want beziet men hen van boven, dan blijkt bij de eerste de volgorde H, OH, COOH die van de wijzers van het uurwerk te zijn en bij de andere juist andersom! Het is dus te begrijpen, dat de eerste formule een melkzuur voorstelt, dat b.v. het vlak van het gepolariseerd licht naar rechts draait, terwijl de tweede formule een tegengesteld draaiend melkzuur voorstelt. De voorwaarde, dat men van een formule twee dergelijke, niet tot dekking te brengen spiegelbeelden kan opstellen, is, dat er in het molecule voorkomt een koolstofatoom gebonden met vier verschillende groepen, een asymmetrisch koolstofatoom. Dit is het middelste koolstofatoom bij melkzuur en bij appelzuur b.v. het tweede C atoom van links: 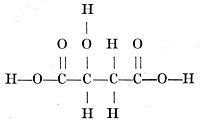 | |
[pagina 20]
| |
Maar bij het barnsteenzuur komt een dergelijk asymmetrisch koolstofatoom niet voor: 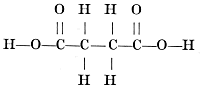 Van appelzuur zijn een links en een rechts draaiende vorm bekend, van barnsteenzuur maar één, inactieve vorm. Niet alleen kon dus met de voorstelling, dat het koolstofatoom een tetraëder is, het bestaan van optisch actieve (d.w.z. het polarisatievlak draaiende) vormen verklaard, maar ook voorspeld worden! Maar nog een andere moeilijkheid kon Van 't Hoff verklaren. Furmaarzuur en maleïnezuur hebben beide de formule: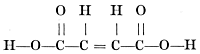 en zijn toch geheel verschillend. Echter, in het midden van het molecule zijn twee koolstofatomen dubbel met elkander gebonden. De viervlakken, die deze twee koolstofatomen voorstellen, moeten elkander dus volgens een ribbe raken en men krijgt twee formules, die niet elkanders spiegelbeeld zijn, maar sterker verschillen en waarvan de een dus maleïnezuur en de ander fumaarzuur zal voorstellen: 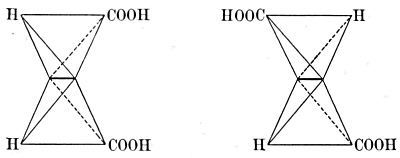 Van 't Hoff's geniale phantasie had hem hier de verklaring geleverd van moeilijkheden, waar over de grootste onderzoekers tevergeefs hadden gepeinsd. Zooals reeds gezegd is, beschrijft hij dit alles in een brochure, het ‘Voorstel tot uitbreiding enz.’, welke hij op zijn eigen kosten laat drukken. En nu kunnen wij ons zoo goed voorstellen, hoe Van 't Hoff na de verschijning dag aan dag popelend heeft zitten wachten, wat | |
[pagina 21]
| |
de chemische wereld wel van zijn ideeën zou zeggen. Zeker zou men zijn gedachten met enthousiasme aanvaarden. Misschien zouden enkelen een bestrijding leveren, maar die zou hij wel weten te overtuigen! En de chemische wereld zei... niets. Niemand schonk eenige aandacht aan de brochure. De oorzaak zou natuurlijk wel zijn, dat het stuk in de Hollandsche taal gesteld was. Nu kon het buitenland het niet lezen. Er verscheen dus een Fransche vertaling in de ‘Archives Néerlandaises des Sciences exactes et Naturelles’ en... niemand nam er eenige notitie van. Onderwijl voldeed Van 't Hoff echter aan de wensch van zijn ouders, zijn studie te voltooien en op 22 December 1874 behaalde hij de doctorstitel op een proefschrift, dat vrij middelmatig was en in niets uitstak boven de tallooze proefschriften, die in ons land geschreven zijn en worden. Nu verliet hij Utrecht om voorloopig bij zijn ouders in Rotterdam te wonen tot hij een plaats als leeraar aan een Hoogere Burgerschool gevonden zou hebben. Zijn vrije tijd besteedde hij om zijn ‘Voorstel tot uitbreiding’ nog eens om te werken en in het Fransch te vertalen. In Mei kwam het opnieuw uit onder de titel: ‘La chimie dans l'espace’ (d.w.z. de scheikunde in de ruimte). In de voorrede beklaagde hij er zich bitter over, dat zijn vorige brochure bijna volkomen doodgezwegen was, maar ook dit boekje vond geen belangstelling. Alleen in Parijs hadden enkele scheikundigen er over gesproken, maar dit kwam door het uiterst merkwaardige toeval, dat Le Bel, met wien Van 't Hoff bij zijn verblijf in de Fransche hoofdstad kennis gemaakt had, volkomen onafhankelijk een enkele maand na hem analoge ideeën had gepubliceerd, waarom dan ook altijd gesproken wordt van het tetraëdermodel van Van 't Hoff-Le Bel. In Holland was het pas op 1 October 1875, dat in het Maandblad voor Natuurwetenschappen een open brief van Prof. Buys Ballot verscheen, waarin deze voormalige leeraar van Van 't Hoff zijn werk besprak, op enkele punten critiek uitoefende, maar hem verder aanspoorde en bemoedigde. Kort daarop ontving Van 't Hoff een brief van Wislicenus, wiens onderzoekingen over het melkzuur de stoot tot het ontstaan van de theorie van het asymmetrisch koolstofatoom hadden gegeven. Hierin sprak Wislicenus zich uiterst waardeerend | |
[pagina 22]
| |
over de theorie uit en verzocht toestemming voor de uitgave van een Duitsche vertaling van ‘La chimie dans l'espace’, welke door zijn assistent Dr. Herrmann bewerkt zou worden. Deze vertaling verscheen dan ook tegen het einde van het jaar 1876 voorzien van een voorwoord van Wislicenus onder den titel: ‘Die Lagerung der Atome im Raume’ (de ligging der atomen in de ruimte). | |
Sollicitatie.Van 't Hoff had deze aanmoedigingen hard noodig, want zijn pogingen om zelf zijn brood te verdienen mislukten volkomen. Noch in Breda, noch in Dordrecht of in Leeuwarden hadden zijn sollicitaties voor een leeraarsbetrekking succes. Er is een oordeel over hem bekend van den toenmaligen directeur van de H.B.S. in Breda, die in een brief aan den inspecteur van het middelbaar onderwijs op 19 December 1857 schreef: ‘Gisteren was Dr. J.H. van 't Hoff uit Rotterdam bij mij... Zoover ik oppervlakkig zien kan, maakt hij de indruk van een uitvinder. Hij peinst, hij is verdiept in zijn ontdekking, deze is dat in de koolstofatomen, die het gepolariseerd licht draaien, het koolstofatoom waarschijnlijk een symmetrische tetraëder is, wiens hoeken de richtingen van de affiniteiten aangeven. Hij ziet er slordig uit. Collega's, die hem in de Club zagen protesteeren tegen zijn coöptatie en zeggen: dat is geen man voor Breda. Ik vrees, dat hij zeer verstrooid zal zijn en dat hij met de leerlingen moeilijkheden zal hebben...’ In arren moede vroeg Van 't Hoff aan zijn vader honderd gulden en reisde hiermede terug naar Utrecht, waar hij een kamer met pension voor de somma van één gulden per dag huurde. In de kranten zette hij een advertentie, waarin hij zich aanbood tot het geven van privaatlessen in chemie, natuurkunde enz. en hij kreeg ook werkelijk enkele leerlingen. Op 1 Maart 1876 werd onze jonge doctor benoemd tot assistent aan de veeartsenijkundige school te Utrecht op een salaris van 1200 gld. Den directeur Mac Gillavry was de open brief van Buys Ballot aan Van 't Hoff opgevallen; hij had Van 't Hoff bij zich laten komen en het gevolg was diens benoeming geweest. | |
Eerste succes.Een vorstelijk bezoek maakte, dat de aandacht van het groote | |
[pagina 23]
| |
publiek op Van 't Hoff viel. De toenmalige keizer van Brazilië, Dom Pedro II bezocht op een studiereis door Europa ook Amsterdam en den daar werkzamen Prof. in de chemie J.W. Gunning, met wien hij verschillende chemische vraagstukken besprak. Het gesprek kwam hierbij op Van 't Hoffs theorie en dit interesseerde den keizer in zoo sterke mate, dat hij op 23 Juli 1876 den assistent van de vee-artsenijkundige school een bezoek bracht en zich persoonlijk de theorie aan de hand van modellen liet demonstreeren, waarbij hij de meening uitsprak, dat deze modellen als speelgoed in de handel gebracht bij kinderen reeds vroegtijdig de chemische kennis zouden kunnen ontwikkelen! Het eerste wetenschappelijke eerbewijs, dat Van 't Hoff ten deel viel, was op 11 October 1876, toen hij benoemd werd tot lid van het Genootschap ter bevordering van Natuur-, Genees- en Heelkunde te Amsterdam. Ook hiervoor had Gunning gezorgd. Eenige maanden later viel echter de slag. In Leipzig troonde een professor in de chemie, Hermann Kolbe, een zeer knap man, die o.a. de bereidingsmethode van het middel tegen rheumatiek, salicylzuur gevonden had. Deze zag met verachting neer op het knikkerspel, dat zijn meeste chemische collega's bedreven. Scheikunde beoefenen, door knikkertjes met haakjes aan elkander te hangen leek hem het summum van onwetenschappelijkheid en in een fulminant artikel: ‘Teekenen des tijds’ had hij aan deze opvatting uiting gegeven. Nu kwam hem ‘Die Lagerung der Atome im Raume’ in handen, waarin hij tot zijn afgrijzen zag, dat zij tegenwoordig de knikkers niet meer plat op tafel lieten liggen, maar er ook al mee in de hoogte begonnen te bouwen en brieschend schoot hij achter zijn schrijftafel. Het gevolg was een artikel: Teekenen des tijds II (Mei 1877). ‘Kort geleden heb ik als een van de oorzaken van de teruggang van het chemisch onderzoek in Duitschland het gebrek aan algemeene en ook aan grondige chemische ontwikkeling aangegeven, waaraan een niet onaanzienlijke hoeveelheid van onze chemische professoren tot groot nadeel der wetenschap laboreert. Het gevolg daarvan is het voortwoekeren van het onkruid van de geleerd en geestvol schijnende, in werkelijkheid triviale, geestelooze natuurphilosophie, welke voor 50 jaar door het exacte natuuronderzoek op zijde geschoven was, maar tegenwoordig door pseudonatuuronder- | |
[pagina 24]
| |
zoekers uit de de dwalingen van de menschelijke geest bevattende rommelkamer te voorschijn is gehaald en die men tracht als een lichtekooi, modern aangekleed en versch geschminkt in goed gezelschap, waar zij niet behoort, binnen te smokkelen. Wien deze bezorgdheid overdreven schijnt, die leze, indien hij het vermag, het kort geleden verschenen van phantasie-spelletjes uitpuilende geschrift van Van 't Hoff en Herrmann over de ligging der atomen in de ruimte... Een zekere Dr. J.H. van 't Hoff, aan de vee-artsenijschool te Utrecht aangesteld, heeft naar het schijnt in exact chemisch onderzoek niet veel zin. Hij heeft het gemakkelijker gevonden Pegasus te bestijgen (zeker uit de vee-artsenijschool gehaald) en in zijn “Chimie dans l'espace” te verkondigen, hoe hem op zijn met een koene vlucht beklommen chemische Parnassus de atomen in de wereldruimte opeengestapeld verschenen zijn. De prosaïsche chemische wereld vond weinig smaak in deze hallucinaties, daarom poogde Dr. F. Herrmann door een Duitsche vertaling deze verdere voorbereiding te bezorgen... Dit geschrift ook maar ten deele te bespreken is niet mogelijk, daar de uitingen der phantasie daarin elke grond ontberen en den nuchteren onderzoeker volkomen onbegrijpelijk zijn... Ik zou, zooals gezegd, van dit werk geen notitie genomen hebben, als niet onbegrijpelijkerwijze Wislicenus dit van een voorwoord had voorzien. Het behoort tot de teekenen des tijds, dat de moderne chemici zich geroepen en in staat achten voor alles een verklaring te geven en als daartoe de bekende ervaringen niet toereikend zijn, naar bovennatuurlijke verklaringen te grijpen. Zulk een van heksengeloof en spokenklopperij niet ver verwijderde behandeling van natuurwetenschappelijke vragen houdt ook Wislicenus voor toelaatbaar.’ Hiermede was Van 't Hoff volkomen vernietigd en er bleef slechts over de resten bij elkander te vegen en in een hoek te deponeeren. Maar als er bij de gewone menschen een boek is, waar niemand aandacht aan schenkt en er komt een mijnheer met een bijzonder ontwikkeld zedelijkheidsgevoel, die een woedend stuk schrijft, dat het boek zoo onnetjes en laag bij de grond is, dan maakt hij de beste reclame, die zich denken laat. Iedereen moet het boek lezen en de oplage verveelvoudigt zich. Nu zijn chemici toch eigenlijk ook maar gewone menschen en is het dus te begrijpen, dat iedere chemicus dat | |
[pagina 25]
| |
vréééselijk onnette boek van dien assistent uit Utrecht, waar Professor Kolbe zoo over te keer ging, gelezen wilde hebben. En zooals gewoonlijk, toen men het las, viel het een beetje erg tegen, want het was heelemaal niet onnetjes, maar er stonden dingen in, die toch heusch nog niet zoo gek waren. En van deze tijd af begint de roem van Van 't Hoff! | |
Hoogleeraar te Amsterdam.12 September 1877 wordt Van 't Hoff door toedoen van Gunning en op aanbeveling van Wurz benoemd tot lector aan de universiteit te Amsterdam en reeds op 11 October 1878 bevorderd tot hoogleeraar in de chemie, mineralogie en geologie. Zijn finantiëele omstandigheden waren sterk verbeterd en verloving en huwelijk (met een dochter van den Rotterdamschen groothandelaar Mees) volgen spoedig. Voor zijn intreerede als hoogleeraar had Van 't Hoff een bijzonder eigenaardig onderwerp gekozen. Aanknoopend aan de critiek van Kolbe, die hem zijn ongebreidelde phantasie op de scherpste manier verweten had, sprak hij over: de phantasie in de wetenschap. Hierin bewees hij de groote rol, die de phantasie speelt bij de ontwikkeling der wetenschap; hoe vele groote denkers door hun phantasie geleid werden en zelfs dikwijls ziekelijke phantasieën hebben gehad. De jaren, die Van 't Hoff in Amsterdam doorbracht (1877-1895) vormen het hoogtepunt van zijn wetenschappelijke loopbaan. Zijn rijke phantasie ontplooit zich volkomen en hij vindt gelegenheid zijn denkbeelden door eigen proeven en door die zijner leerlingen te stutten. Want volkomen ongelijk had Kolbe niet gehad. Jaarlijks verschijnen er geschriften, die door geen enkel experiment gestutte phantastische opvattingen over de natuurwetenschappen verkondigen en die gewoonlijk het papier niet waard zijn, waarop zij gedrukt zijn. Ook Van 't Hoff had, toen hij zijn ‘Voorstel tot uitbreiding’ deed, geen enkele proef gedaan tot bevestiging van zijn opvattingen en dat is hem ook van andere zijde kwalijk genomen. Onderzoekers als Le Bel, Wislicenus en Emil Fischer hebben de experimenten geleverd, noodig tot steun der theorie en Van 't Hoff heeft aan de ontwikkeling van de theorie van het asymmetrisch koolstofatoom nauwelijks verder deel genomen. | |
[pagina 26]
| |
Wel heeft hij nog een boek geschreven: ‘Ansichten über die organische Chemie’ (opvattingen over de organische chemie) waaraan hij al in Utrecht begonnen was en dat hij in het begin van zijn Amsterdamsche periode voltooide. Maar dit werk heeft, en naar hij zelf later verklaarde terecht, geen belangstelling gewekt. Toch heeft het schrijven hiervan zijn nut gehad. Hij tracht namelijk zoo algemeen mogelijk de vraag te beantwoorden: wat zal er onder bepaalde omstandigheden, na bepaalde tijd, gebeurd zijn, als men verschillende chemische stoffen bij elkander brengt? Dit vraagstuk moet, gegeven zijnde de eigenschappen van de bij elkander gebrachte stoffen, volkomen bepaald zijn en bij haar oplossing zal natuurlijk de snelheid van de plaats grijpende veranderingen, de reactiesnelheid dus, een groote rol spelen. Van 't Hoff ziet echter in, dat de verbindingen der organische chemie veel te ingewikkeld zijn, om genoemd vraagstuk met eenige kans op succes te kunnen aangrijpen en dat de desbetreffende studies aan eenvoudiger verbindingen gemaakt moeten worden. Maar hierdoor wordt hij een van de belangrijkste, zoo niet de belangrijkste grondlegger van een nieuw gebied van wetenschap, de physische chemie, een grensgebied tusschen scheikunde en natuurkunde. Hij is het vooral, die als eerste de methoden van de natuurkunde en in het bijzonder van de wiskunde op de scheikunde weet toe te passen. | |
De ‘Études de dynamique chimique’.Als vrucht van een zevenjarige werkzaamheid verschijnt in 1884 de ‘Études de dynamique chimique’ (studies over de leer der chemische bewegingsverschijnselen). In de eerste plaats onderzoekt Van 't Hoff hierin de snelheid van een scheikundige reactie. Het was al lang bekend, dat een chemische omzetting des te vlugger gaat, naarmate de temperatuur hooger is. Vandaar, dat men om een bepaalde reactie te weeg te brengen in het algemeen moet verhitten. Het gelukt nu aan Van 't Hoff om een wiskundige formule te vinden, waaruit men kan berekenen, hoeveel maal sneller een reactie gaat, als men een bepaald aantal graden verhit. Maar in tegenstelling met wat hij in zijn eerste werk, het ‘Voorstel tot uitbreiding’ had gedaan, beschrijft hij hierbij ook direct proeven, waaruit blijkt, dat de gevonden formule juist is. Deze veranderde handelwijze maakt dan ook, dat de ‘Études’ bij hun verschijnen direct door de geheele | |
[pagina 27]
| |
chemische wereld als een uiterst belangrijk werk worden begroet. Echter niet alleen met de bepaling van de reactiesnelheid houdt Van 't Hoff zich bezig. Hij beschouwt ook de chemische evenwichten. Als men n.l. verschillende stoffen bij elkander brengt, dan kan het gebeuren, dat de optredende omzetting maar tot een bepaald punt voortschrijdt en dan stopt. Als men b.v. amylacetaat (de naar perenzuurtjes riekende vloeistof, die bij de bereiding van autolak en nagellak wordt gebruikt; beide lakken zijn oplossingen van celluloseacetaat, het bekende glaspapier, in amylacetaat) met water samenbrengt, dan ontleedt het amylacetaat in een stof genaamd amylalcohol en in azijnzuur. amylacetaat + water → amylalcohol + azijnzuur. Maar niet al het amylacetaat wordt omgezet. Er blijft wat over. Omgekeerd, als men amylalcohol en azijnzuur bij elkander voegt, ontstaat er amylacetaat en water, maar ook weer niet volledig: amylalcohol + azijnzuur → amylacetaat + water. De reactie leidt dus steeds tot een bepaald evenwicht, waarna, indien dit bereikt is, geen verdere verandering optreedt. Dit laatste is nu echter volgens Van 't Hoff niet juist. Bij de reactie amylacetaat + water ⇄ amylalcohol + azijnzuur blijft zich, ook al is het evenwicht bereikt, voortdurend amylalcohol en azijnzuur vormen, maar even snel als het zich vormt, verbindt een hoeveelheid amylalcohol met azijnzuur zich weer tot amylacetaat en water. Het evenwicht zal dus bereikt zijn, als de snelheid van de heengaande en van de teruggaande reactie even groot geworden zijn. Ter verduidelijking van deze belangrijke gedachtengang kunnen wij ons een stad denken, die laat ons zeggen honderdduizend inwoners telt. Blijft dit inwonertal gedurende eenige jaren honderdduizend, dan kunnen wij zeggen, dat de bevolking in evenwicht is. Maar dit evenwicht is nietstatisch, hetgeen beteekenen zou, dat er niemand dood gaat en ook niemand geboren wordt, maar het is dynamisch, de aanvoer en de afvoer is even groot; er worden evenveel personen geboren als er overlijden. Een ander prachtig voorbeeld van een dynamisch evenwicht is een | |
[pagina 28]
| |
rustig brandende kaarsvlam, waarin ook op elk oogenblik evenveel stof aan- als afgevoerd wordt. En nu beschouwt Van 't Hoff ook het chemisch evenwicht als een dynamisch evenwicht en deze opvatting stelt hem weer in staat een uiterst belangrijke wiskundige formule te bedenken, die aangeeft, hoe de plaats van het evenwicht, dus de hoeveelheid van de aanwezige stoffen, zal veranderen als men de temperatuur verandert. Hierbij leidt hij tevens een grondbeginsel af, het wereldberoemde principe van Van 't Hoff voor een bewegelijk evenwicht. Zooals reeds gezegd, bestaat een chemisch evenwicht uit twee reacties, een heen- en een teruggaande reactie, die met gelijke snelheid verloopen. In het algemeen zal echter, indien een van de twee reacties optreedt, b.v. de heengaande, warmte ontwikkeld worden en dus zal er bij de tegenovergestelde reactie juist het tegenovergestelde gebeuren en warmte worden opgenomen. Denk b.v. aan een mengsel van ijs en water. Dit kunnen wij ons als een evenwicht voorstellen, want het ijs kan in water overgaan en het water kan zich in ijs omzetten. Bij de eerst genoemde reactie moet echter warmte worden toegevoerd om het ys te doen smelten, terwijl er bij het bevriezen van water juist warmte vrij komt. Het evenwicht laat zich dus als volgt voorstellen: water ⇄ ijs + warmte. Het principe van Van 't Hoff zegt nu: Ieder evenwicht tusschen twee verschillende toestanden van de materie wordt bij constant volume door een temperatuursverlaging naar de kant van die toestand verschoven, welks vorming warmte voortbrengt. Als we dit principe op het evenwicht water ⇄ ijs toepassen, dan is de toestand ijs die toestand, welks vorming warmte voortbrengt; het principe zegt dus, dat bij temperatuursverlaging water in ijs zal overgaan. Dit was nu een bijzonder eenvoudig voorbeeld en minder belangrijk, daar wij het antwoord eigenlijk al wisten. Laten wij daarom nog een iets ingewikkelder geval beschouwen: Als men een zout zooals soda of salpeter in water oplost, dan blijkt in de meeste gevallen de oplossing iets kouder te zijn geworden. Voor het oplossen is dus warmte noodig. Men kan het evenwicht opstellen: warmte + zout in vaste toestand ⇄ zout in oplossing | |
[pagina 29]
| |
Maar daar het omgekeerde van het genoemde principe ook geldt, volgt hieruit, dat bij temperatuursverhooging de reactie naar rechts zal verschuiven, met andere woorden, dat het zout bij temperatuursverhooging beter in water zal oplossen, of anders gezegd, dat zijn oplosbaarheid bij temperatuursverhoog nog grooter wordt. Maar bij het oplossen van gewoon keukenzout in water wordt er nauwelijks warmte opgenomen. Het principe laat dan ook direct de gevolgtrekking toe, dat de oplosbaarheid van keukenzout bij stijgende temperatuur nauwelijks zal toenemen. Ook bij ingewikkelder gevallen laat het principe ons niet in de steek. Het is dan ook onder de belangrijkste resultaten van de physische chemie te rekenen en zijn opstelling heeft er sterk toe bij gedragen Van 't Hoffs naam wereldberoemd te maken. Ten slotte behandelt Van 't Hoff in de ‘Études de chimie dynamique’ nog een onderwerp, dat voor zijn verdere leven zijn lievelingsonderwerp zal blijken te blijven, de gecondenseerde systemen. Onder een systeem verstaat men in de scheikunde een evenwicht tusschen verschillende toestanden van de stof, b.v. water en ijs of zout en een verzadigde waterige oplossing van het zout. Onder gecondenseerde systemen vat men nu die systemen samen, in welke de verschillende toestanden een constante samenstelling hebben. Water en ijs is dus een gecondenseerd systeem, want water heeft steeds dezelfde samenstelling en ijs ook. Maar een systeem opgebouwd uit zout en een verzadigde oplossing van het zout is geen gecondenseerd systeem, want bij temperatuursverhooging zal de verzadigde oplossing meer zout gaan bevatten en dus niet constant van samenstelling zijn. Hij kon nu bewijzen, dat evenals ijs onder bepaalde druk smelt bij één zeer bepaalde temperatuur, ook voor deze gecondenseerde systemen onder bepaalde druk een zeer bepaalde temperatuur is aan te geven, de overgangstemperatuur, waarbij de eene toestand zich in de andere omzet. Experimenteel werd dit bewezen aan de stof zwavel. Van zwavel was bekend, dat het bij gewone temperatuur voorkomt in een vorm, die men rhombische zwavel noemt en die in dikke prismas kristalliseert. Bij hoogere temperatuur vormt zich de monokline zwavel, wier kristalvorm uit lange dunnere naalden bestaat. Van 't Hoff trok dus de gevolgtrekking, dat er bij gewone druk een bepaalde temperatuur bestaat, boven welke de monokline zwavel stabiel | |
[pagina 30]
| |
moet zijn en de rhombische metastabiel, d.w.z. boven die temperatuur moet de rhombische zwavel zich in de monokline omzetten en beneden die temperatuur moet het juist omgekeerd zijn. Uit de druk van de damp van de twee zwavelsoorten kon Van 't Hoff berekenen, dat het gezochte overgangspunt bij 96.3o moet liggen. Zijn leerling Reicher heeft dit overgangspunt bepaald met een dilatometer, wat eigenlijk niets anders is dan een groote thermometer, dus een holle glazen bol met daaraan gesmolten een holle steel, welke een schaalverdeeling bevat. In de bol was een mengsel gebracht van rhombische en monokline zwavel en verder was de bol en een deel van de steel gevuld met een vloeistof. Nu heeft hetzelfde gewicht rhombische zwavel een kleiner volume dan dat van monokline zwavel. Gaat dus monokline zwavel in rhombische zwavel over, dan wordt het volume kleiner en zal de vloeistof in de steel dalen en in het tegenovergestelde geval zal de vloeistof in de steel stijgen. Het bleek nu, dat bij temperaturen onder 95.6° de vloeistof voortdurend daalde (waarbij de temperatuur natuurlijk constant werd gehouden), bij temperaturen er boven voortdurend steeg en alleen bij 95.6° op dezelfde hoogte bleef, zoodat bij deze temperatuur het gezochte overgangspunt lag in uitstekende overeenstemming met de berekening van Van 't Hoff. Eerst gelukte het echter aan Reicher niet het gezochte overgangspunt te vinden en na een maand van ingespannen maar vruchtelooze arbeid begon deze langzamerhand wanhopig te worden. Van 't Hoff was zoo rotsvast overtuigd van de juistheid van zijn berekeningen, dat toen hij dit bemerkte, hij meteen verklaarde: ‘ik begrijp dat je lust tot dit werk minder wordt en dat je liever een ander onderwerp zou willen kiezen; maar ik zeg je één ding: ik heb de overgangstemperatuur van zwavel berekend en ik heb de vaste overtuiging, dat ze bestaat en wel op de berekende hoogte. Geef jij het onderzoek op, dan zet ik het direct voort’. Men begrijpt, hoe de leerling, door deze toespraak aangespoord, het werk met vernieuwde ijver voortzette en spoedig smaakte deze de voldoening het overgangspunt van zwavel vinden. | |
Verhouding tot zijn leerlingen.In het voorgaande is een leerling van Van 't Hoff, Reicher genoemd en daarom lijkt het hier de plaats om iets te zeggen over het onder- | |
[pagina 31]
| |
wijs, dat Van 't Hoff in Amsterdam gaf. Met den anderen en ouderen hoogleeraar in de scheikunde J.W. Gunning, die zooals reeds gezegd is, de hoofdpersoon was geweest, welke de beroeping van Van 't Hoff naar Amsterdam had bewerkstelligd, was besproken, dat de verdeeling van de chemische leerstof tusschen hen beiden niet zou zijn de gewone in anorganische en organische chemie, maar dat de een de algemeene chemie, dus de grondbeginselen en leidende principes zou doceeren en de ander de bijzondere scheikunde. Maar deze indeeling had het nadeel, dat de studenten wel eens twee maal hetzelfde te hooren kregen, zoodat later een andere indeeling tot stand kwam, die zich weer nauwer bij de gebruikelijke aansloot. Ook klaagden de studenten er over, dat het slechte schrift van Van 't Hoff op de laatste banken in de collegezaal niet te lezen was! Verder, de Prof zag er heelemaal niet uit als een Prof, bescheiden, eenvoudig, eigenlijk een beetje verlegen. Maar dit was niet zoo erg, de amanuensis (bediende) Claessens, die bij de colleges hielp en op uitstekende wijze hielp, was een zelfbewust statig man met een groote zwarte baard, zoodat de studenten dezen met de titel Professor begiftigden. Zij hadden toch in elk geval op het college een heelen Professor voor zich; de een had de geleerdheid en de ander de manieren! Niet alleen studenten, maar ook anderen waren van dezelfde meening. Reicher, de assistent van Van 't Hoff vertelt, dat hij eens met een bezoeker in het laboratorium was, toen de amanuensis binnen kwam en door den bezoeker allereerbiedigst werd gegroet als zijnde de Hooggeleerde Professor Van 't Hoff. De rechtmatige bezitter van deze naam werd kort daarop bij zijn binnenkomst met geen blik verwaardigd. ‘Dit bescheiden ventje met het uiterlijk van een H.B.S.er zou de groote Van 't Hoff zijn? Je wil mij zeker voor de gek houden.’ Trouwens van dit bescheiden uiterlijk werd een van Van 't Hoffs eigen assistenten nog de dupe, een voorval, waarom zijn collega's veel gelachen hebben, maar dat de desbetreffende assistent zelf toch wel niet zoo erg prettig gevonden zal hebben. Deze assistent was op een donkere namiddag in de zaal, waar de a.s. medici practicum hadden. Terwijl hij een van hen helpt, ziet hij naast zich kijkend een ander bezig met reageeren en wel op een wijze, die hij niet juist acht. Hij zegt dus: ‘ik geloof, dat U daar iets verkeerd doet, ik zou het liever zoo doen’ waarop tot zijn pijnlijke verbazing de hoogleeraar in eigen persoon, die ongemerkt de trap af gekomen was om mede te | |
[pagina 32]
| |
helpen, antwoordt: ‘ik dank je ten zeerste voor je goede raad en ik zal hem voortaan opvolgen.’ Misschien heeft dit verhaaltje, dat Van 't Hoff door zijn eigen assistenten op de vingers getikt werd, wel aanleiding gegeven tot de legende, dat Van 't Hoff de eerste chemicus is geweest, die beroemd is geworden zonder een experimentator te zijn, een verhaal, dat door Van 't Hoffs leerlingen, die dagelijks met hem in aanraking waren geweest, ten sterkste werd tegengesproken. Wel had hij geen geduld om een menigte stoffen te analyseeren of om tallooze oplosbaarheidsbepalingen uit te voeren en was het bij menig onderzoek de leerling, die de proeven uitvoerde om de theorie te staven, maar dan was het toch een idee van Van 't Hoff, die de wijze van experimenteeren beheerschte. Hij had een bijzondere gave eenvoudige toestellen te bedenken geschikt om het verlangde met voldoende graad van nauwkeurigheid te bepalen, waarbij hij uitstekend het beoogde doel van de nevenomstandigheden wist te scheiden. Bovengenoemd voorval met den assistent bewijst ook Van 't Hoffs groot gevoel voor humor, iets wat uit zijn brieven naar voren komt en wat ook blijkt uit volgende anecdote: Op een dag kwamen twee medische studenten bij hem om zich voor het practicum op te geven. Op de vraag naar hun naam antwoordde de eerste aan den Professor: ‘ik ben De Oude’ en prompt daarop de ander: ‘en ik ben De Jonge’. Van 't Hoff vertrok geen spier van zijn gelaat, maar toen zij weg waren, barstte hij in lachen uit en riep: ‘dat hebben zij natuurlijk met elkander afgesproken.’ Gevangen als hij was door zijn idee, de idee van de analogie tusschen de natuurkundige en de scheikundige verschijnselen, ontwikkelde hij hier in Amsterdam een geweldige werkkracht en het is geen wonder, dat Mevrouw Van 't Hoff het van tijd tot tijd geraden vond haar echtgenoot in de namiddag van zijn laboratorium af te halen uit angst, dat hij het middagmaal, een toch zeker ook belangrijke factor in het leven van een mensch, zou vergeten. Als laboratorium had Van 't Hoff de beschikking over een gebouw op de Groeneburgwal, donker en door de steeds toenemende hoeveelheid studenten spoedig veel te klein. Maar van een nieuw laboratorium kwam voorloopig niets. Echter, Van 't Hoff kon werken te midden van drukte en lawaai. Zijn privélaboratorium geleek volgens zijn eigen woorden meer op een chemische beurs en in zijn eigen huis | |
[pagina 33]
| |
 Diploma en medaille behoorende bij de Nobelprijs.
| |
[pagina 34]
| |
 Van 't Hoff omstreeks 1900.
 Het monument voor van 't Hoff te Rotterdam.
| |
[pagina 35]
| |
wilde hij geen eigen studeerkamer hebben, maar werkte hij te midden van zijn spelende kinderen. | |
De theorie der verdunde oplossingen.Nadat in 1884 de ‘Études de dynamique chimique’ waren verschenen, bracht het volgend jaar weer een drietal zeer belangrijke verhandelingen, die in een Zweedsch tijdschrift werden opgenomen. In deze verhandelingen beschrijft Van 't Hoff de theorie van de verdunde oplossingen en leidt hij haar wetten uit bepaalde grondbegrippen af. Hierbij maakt hij gebruik van een zeer bepaalde veronderstelling, die hij ook al toegepast had in zijn Études, de veronderstelling van de half-doorlaatbare wand. Onder een dergelijke wand wordt namelijk verstaan een tusschenschot, waardoor wel het oplosmiddel (in verreweg de meeste gevallen water) zou kunnen heendringen (diffundeeren), maar niet de opgeloste stof. Plantaardige en dierlijke vliezen vormen bij groote benadering dergelijke halfdoorlaatbare wanden en zij spelen, zooals men direct begrijpen kan, een bijzonder groote rol in de levende natuur, want zij maken, dat plant of dier water kan opnemen of verliezen, zonder kostbare lichaamsstoffen kwijt te raken. Brengt men nu in een zak van een dergelijke halfdoorlaatbare wand gemaakt (het eenvoudigst neemt men daarvoor een varkensblaas) b.v. een oplossing van suiker in water en hangt men de gevulde zak in zuiver water, dan zal blijken, dat het water door de zak naar buiten of naar binnen kan diffundeeren, maar dat de suiker er bijna niet doorheen treedt en dus binnen in de zak blijft. Echter blijkt ook, dat er veel meer water van buiten naar binnen gaat dan andersom en dat dus het volume van de suikeroplossing voortdurend toeneemt, maar dat deze oplossing ook voortdurend verdunder wordt. Wil men beletten, dat er water van buiten naar binnen komt, dan moet men op de suikeroplossing een zeer bepaalde druk uitoefenen, die de osmotische druk genoemd wordt. Oefent men een grootere druk uit dan gaat er water van binnen naar buiten, is de druk te klein, dan gaat er water van buiten naar binnen. Het eenvoudigst oefent men deze druk op de oplossing binnen in de varkensblaas uit door de blaas dicht te binden; er komt wat water bij, de blaas gaat gespannen staan en zorgt zelf voor de noodige druk, als hij ten minste | |
[pagina 36]
| |
niet te zwak is, want dan kan hij springen. Deze osmotische druk is de oorzaak van vele bekende verschijnselen. B.v. als men erwten, boonen of andere plantenzaden in water brengt, gaan deze zwellen. Hun wand vormt n.l. een half-doorlaatbare wand, het water dringt er wel door naar binnen, maar de eiwitstoffen en het zetmeel in het zaad niet naar buiten. Ook het opfrisschen van verwelkte planten staat hiermede in verband. Verwelkte planten bevatten te weinig water; geeft men hun nu water, dan diffundeert het water door de half-doorlaatbare wand van de plantencel naar binnen. Maar deze cellen zijn alzijdig gesloten zakjes; zij gaan gespannen staan en daardoor krijgt de geheele plant zijn spankracht, zijn turgor terug. Verder, zuiver water is eigenlijk een vergift! Als iemand veel bloed verloren heeft, kan men hem dikwijls redden door hem water in zijn aderen te spuiten. Maar gebruikt men hiervoor zuiver water dan heeft dit zeer ernstige gevolgen. De bloedlichaampjes in het bloed zijn evenals de plantencellen te beschouwen als zakjes, vervaardigd van een halfdoorlaatbare wand; het water zal in deze zakjes naar binnen dringen en het gevolg zal zijn, dat de bloedlichaampjes barsten. Daarom gebruikt men in dit geval een z.g. physiologische keukenzout-oplossing, een oplossing dus van gewoon keukenzout in water van bepaalde sterkte. Deze keukenzout-oplossing trekt als het ware even sterk het water aan als de inhoud van de bloedlichaampjes, heeft dus dezelfde osmotische druk of zooals men ook wel zegt: is isotonisch met de inhoud van de bloedlichaampjes en deze zullen dus water opnemen noch verliezen en dus zwellen noch krimpen. Uit de genoemde voorbeelden kan men al zien, dat het begrip osmotische druk een zeer groote rol speelt in de biologie (de wetenschap van de levende natuur) en in de geneeskunde. In de kringen van de beoefenaars van genoemde wetenschappen verwierf Van 't Hoff dus een zeer groote vermaardheid, doordat het hem gelukte de grootte van de osmotische druk te berekenen. Deze was eenvoudig als volgt te vinden: men denkt de opgeloste stof in dezelfde maar nu leege ruimte als gas verspreid, de druk, die het dan zou uitoefenen, is gelijk aan de osmotische druk. Eenvoudiger, maar minder juist zegt men wel: de opgeloste stof in een verdunde oplossing gedraagt zich als een gas. Een van de oorzaken, waarom Van 't Hoff genoemde drie verhandelingen in een Zweedsch tijdschrift publiceerde, was, dat een jong | |
[pagina 37]
| |
Zweedsch onderzoeker, Svante Arrhenius, een zeer grondige en welwillende kritiek betreffende de Études had gepubliceerd en zelf ook bezig was met een onderzoek van verdunde oplossingen in het bijzonder wat betreft hun electrische geleidbaarheid. Hierdoor ontstond een correspondentie tusschen beide onderzoekers en Svante Arrhenius gelukte het een moeilijkheid in de theorie van Van 't Hoff betreffende de osmose op te helderen. Van 't Hoff had n.l. gevonden, dat in vele gevallen de osmotische druk grooter was dan hij volgens zijn theorie berekende; Svante Arrhenius wees er nu op, dat dit alleen het geval was bij stoffen, die in waterige oplossing de electrische stroom geleiden en electrolyten genoemd worden (zuren, basen en zouten) en hiervoor had de Zweedsche onderzoeker een theorie opgesteld, waarin hij aannam, dat dergelijke stoffen in waterige oplossing in tegengesteld electrisch geladen deeltjes, ionen genaamd, gesplitst worden. Hierdoor was de osmotische theorie van Van 't Hoff volkomen afgerond geworden en zij werd dan ook uitvoerig behandeld in een omstreeks 1887 verschenen leerboek der physische chemie, het door W. Ostwald uitgegeven ‘Lehrbuch der allgemeinen Chemie’. Dit leerboek, dat de eerste poging was het in tallooze tijdschriftartikelen verspreide materiaal te samen te brengen en te ordenen, verkreeg een groote verbreiding en maakte daardoor dat Van 't Hoffs naam in breede kringen bekend werd. Ook droeg hieraan toe het feit, dat een tijdschrift gesticht werd, speciaal gewijd aan de physische chemie, het ‘Zeitschrift für physikalische Chemie, Stöchiometrie und Verwandtschaftslehre’ en van dit tijdschrift vormde Van 't Hoff met Ostwald de redactie. | |
Beroep naar Leipzig en naar Berlijn.Het gevolg van deze meerdere bekendheid was, dat Van 't Hoff in Juni 1887 door de Universiteit van Leipzig uitgenoodigd werd een professoraat in de physische chemie aan haar inrichting te willen aanvaarden. Toen deze uitnoodiging bekend werd, werden van alle zijden brieven tot Van 't Hoff gericht uit de kringen van zijn vrienden, collega's en vakgenooten, waarin de hoop werd uitgesproken, dat hij zijn vaderland niet zou verlaten. Ook tot de gemeenteraad van Amsterdam werden verzoekschriften gericht met de vraag te bevorderen, dat zoo'n uitnemend geleerde als Van 't Hoff was, niet voor zijn vaderland verloren zou gaan. De burgemeester van Amster- | |
[pagina 38]
| |
dam, die tevens President-curator van het college van curatoren der Amsterdamsche Universiteit is, stelde zich met Van 't Hoff in verbinding ten einde te vernemen op welke voorwaarden deze genegen was in Amsterdam te blijven en de voorwaarden luidden: binnen korte tijd een nieuw gebouwd, goed ingericht laboratorium. Dit werd hem toegezegd en Van 't Hoff besloot Amsterdam trouw te blijven. Nu begonnen langzamerhand de eerbewijzen toe te stroomen en in December 1889 werd Van 't Hoff door de Deutsche Chemische Gesellschaft, een van de belangrijkste vereenigingen op scheikundig gebied, benoemd tot eerelid. Zijn studenten grepen deze gelegenheid aan om hem ook hunnerzijds te huldigen en zij boden hem een portretreliëf aan, waarin gebeeldhouwd de woorden: Physicam chemiae adiunxit (hij voegde de natuurkunde en de scheikunde te samen). In 1893 huldigde ook de Royal Society te Londen hem door de verleening van de Davy-medaille, een medaille, welke jaarlijks uitgereikt moest worden voor de belangrijkste ontdekking op chemisch gebied in Europa of in het Engelsche gedeelte van Amerika. Van 't Hoff verwierf deze medaille tegelijk met Le Bel als een erkenning voor de invoering van de theorie van het asymmetrisch koolstofatoom en haar gebruik bij de verklaring van de constitutie van optisch actieve koolstofverbindingen. Evenals Leipzig trachtte ook de Groningsche Universiteit Van 't Hoff voor zich te winnen, maar ook deze uitnoodiging werd afgeslagen. Onderwijl was het nieuwe laboratorium voor Van 't Hoff gereed gekomen en in September 1892 geopend. Het is het nu nog in gebruik zijnde laboratorium op de hoek van de Nieuwe Prinsengracht en de Roetersstraat, waarin spoedig na de opening een levendig wetenschappelijk leven heerschte. Talrijke onderzoekingen werden hier uitgevoerd door de uit alle oorden te samen gekomen leerlingen van den meester, die tot doel hadden zijn theoriën te toetsen. Maar hierdoor stegen ook de plichten verbonden aan het ambt van hoogleeraar en wel in verdubbelde mate, doordat ook het aantal medici en andere studenten, die de chemie slechts als bijvak noodig hebben, sterk toenam. Maar dit kost tijd, veel tijd, welke gebruikt wordt voor het afnemen van tentamens en examens. Het verlies van deze uren begon Van 't Hoff te verdrieten en ook het algemeen college voor beginners begon hem zwaar te vallen. ‘Als men bijna twintig jaar lang, | |
[pagina 39]
| |
ieder jaar opnieuw, verteld heeft, dat kaliumpermanganaat oxydeerend werkt, dan begint dat te vervelen.’ En daardoor steeg bij hem een ideaal beeld op. Naast mannen, wier plicht het was te onderwijzen en die als hun lust en tijd overbleef, ook onderzoekingen mochten uitvoeren, moesten er ook zijn, wier plicht het was te onderzoeken en die als hun lust en tijd bleef, ook onderwijzen mochten. Aan deze gedachte gaf hij uiting in een rede gehouden bij de opening van het vijfde Nederlandsche Natuur- en Geneeskundige Congres te Amsterdam in April 1895. Het bleek echter, dat het gesprokene geen droombeeld weergaf, maar feiten, die voor Van 't Hoff in het bereik der werkelijkheid lagen, toen hij op 2 Mei van hetzelfde jaar tegen 16 September ontslag verzocht als hoogleeraar aan de Amsterdamsche Universiteit. Wat was namelijk het geval? In Berlijn had men al eens een poging gedaan om hem aan de Universiteit te verbinden, maar deze had geen resultaat gehad. Nu bood men hem een plaats als lid van de Academie van Wetenschappen te Berlijn. Hij behoefde hier slechts één uur in de week college te geven, tenzij hij verhinderd was. Geen tentamina, geen examens, geen beheer van een groot laboratorium en slechts die leerlingen, die hij zelf wenschte aan te nemen en daarbij voldoende finantiëele middelen voor een klein laboratorium. Voor al deze verlokkingen bezweek Van 't Hoff. Heeft hij hier wijs aan gedaan? Zeker was, wat hem trok, de gedachte, dat hij nu al zijn tijd aan zijn eigen onderzoek zou kunnen wijden en daardoor deze onderzoekingen nog beter en belangrijker zou kunnen maken, maar hij vergat, dat de dagelijksche omgang met jongeren de geest jeugdig houdt en het verstand prikkelt en dat hun ‘domme’ vragen juist de aanleiding kunnen zijn tot het optreden van bepaalde gedachtebeelden bij den leermeester en tot het in werking brengen van zijn phantasie, een eigenschap, die Van 't Hoff zelf als de voornaamste van den onderzoeker had beschouwd. En dan het veel gesmade algemeen college, de inleiding dus in de wetenschap voor beginners! Maar dit dwingt den geleerde telken jare zijn geheele wetenschap door de geest te laten gaan, stelt hem steeds nieuwe opgaven en belet hem zich al te sterk op te sluiten in dat deel, dat hij toevallig onderhanden heeft. En al kan men nooit met zekerheid zeggen, dat het | |
[pagina 40]
| |
een het gevolg is van het ander, dan valt wat betreft Van 't Hoff toch niet te ontkennen, dat: hij zijn land heeft verlaten, hij zijn volk heeft verlaten, maar dat zijn genie hém heeft verlaten. Hij heeft zijn land verlaten en dit heeft hij zelf sterk gevoeld, toen hij in 1911 op zijn ziekbed lag, dat zijn doodsbed zou worden. Toen heeft hij terug gewild naar zijn land, naar de streek tusschen Zeist en Doorn, waar hij als kind zijn vacanties doorbracht en als student tochten ondernam. Hier hoopte hij genezing te vinden. Maar voor dit plan tot uitvoering kon komen, overleed hij. Hij heeft zijn volk verlaten, zijn volk, dat hem van een Hollandsch standpunt gezien ruimschoots de eer had gegeven, die hem toekwam, maar dat daartegenover eischte, dat hij iets zou doen, wat het volk direct ten nutte kwam, en hij heeft zich onderworpen aan wat zijn levensbeschrijvers euphemistisch noemen, de formaliteit, die hem wettelijk tot een Duitscher maakte. En daar in het nieuwe land wist hij wel meteen een onderwerp van onderzoek te vinden, dat direct nut zou kunnen afwerpen. Maar zijn genie heeft hem verlaten! Zeker, hij heeft volhardend gewerkt, schitterende onderzoekingen uitgevoerd, die ieder geleerde tot hooge eer zouden strekken, maar geniaal waren deze niet meer, ook zijn vurigste bewonderaar moet dit erkennen. Zoodra bekend werd, dat Van 't Hoff ontslag aangevraagd had, werden van alle zijden pogingen aangewend om hem voor Amsterdam te behouden. De hoogleeraren in de scheikunde en in de natuurkunde aan de verschillende universiteiten richtten een verzoekschrift tot den minister met de bede, alles te trachten in het werk te stellen om Van 't Hoff voor Holland te behouden, een bede, die zij in een audiëntie onderstreepten. De Amsterdamsche Universiteitsvereeniging bood een groote som gelds aan en de minister was wel genegen Van 't Hoff door tusschenkomst van de Koninklijke Academie van Wetenschappen te Amsterdam namens de staat de opdracht te geven zijn krachten aan de ontwikkeling van de chemie te wijden, zoowel door eigen onderzoek als door het aanknoopen van persoonlijke betrekkingen met binnen- en buitenlandsche geleerden en kennisneming in loco van de door deze verkregen resultaten; echter bleef de minister vasthouden aan zijn eisch, dat Van 't Hoff een deel van zijn onder- | |
[pagina 41]
| |
wijs aan de Amsterdamsche Universiteit zou blijven geven. En hierop strandden de onderhandelingen. 30 December 1895 werd Van 't Hoff op eigen verzoek ontslagen als hoogleeraar aan de Amsterdamsche Universiteit. Vooral door personen buiten de kringen der scheikundigen is Van 't Hoff deze geheele gang van zaken zeer kwalijk genomen, terwijl chemici meer de groote eer zagen, die den meester te beurt viel. Vooral verweet men hem, dat hij zorgvuldig verzweeg, waar hij na een vertrek uit Amsterdam zich heen wilde begeven en zijn onderhandelingen dus met een waas van geheimzinnigheid omhulde. Daarbij kwam, dat, nu Van 't Hoff kort geleden een kostbaar laboratorium had verkregen, geheel gebouwd volgens zijn eigen wenschen, men het nu ook als zijn plicht beschouwde, dat hij geruime tijd in Amsterdam bleef. En ten slotte, Van 't Hoff had in Amsterdam met slechts weinig vrienden omgang; zijn eenigszins verlegen en teruggetrokken houding, die b.v. maakte, dat hij dikwijls vergat zijn bezoekers een stoel aan te bieden, deden hem door buitenstaanders als onvriendelijk, onbeleefd en zelfs als hoogmoedig beschouwen. Ook zijn particulier leven bleef niet buiten schot en tallooze roddelpraatjes deden in den lande de rondgang, alle tot inhoud hebbende zijn bekende waardeering van een glas goede wijn. De teekenaar van politieke spotprenten Braakensiek, die veelal scherp wist weer te geven, wat in de Hollandsche harten en gedachten leefde, deed het ook in dit geval met een plaat, die den scheidenden hoogleeraar vergeleek met het mannetje uit het bekende sprookje, dat van een wondervisch al zijn wenschen vervuld kreeg. Ten slotte liepen die wenschen dusdanig op, dat de visch zich genoodzaakt voelde er kortweg een eind aan te maken en ook de reeds vervulde wenschen te niet te doen! | |
Vestiging te Berlijn.Nadat Van 't Hoff op 17 Maart 1896 afscheid van zijn leerlingen had genomen, verhuisde hij naar Berlijn en hield hij in Juli van hetzelfde jaar zijn eerste rede in de kring van de Berlijnsche Academie. In deze rede ontwikkelde hij zijn programma voor de komende jaren. Hij wees er op, hoe het hoofddoel van zijn streven steeds geweest was de scheikunde met de wiskunde te verbinden en hoe hem dat in het deel der wetenschap, dat de invloed van warmte op scheikundige | |
[pagina 42]
| |
verschijnselen nagaat, gelukt was. Nu in zijn nieuwe omgeving dacht hij zich te wijden aan de studie van de gecondenseerde systemen en de daarbij behoorende overgangstemperaturen, waarbij hij in het bijzonder dacht aan een eventueel nut voor de Stassfurter zoutindustrie, al kwam zeker niet in de eerste plaats een mogelijke industrieele toepassing van zijn onderzoekingen. Van 't Hoff stelde zich namelijk tot doel iets te ondernemen, dat zijn nieuwe land tot bijzonder nut kon zijn, iets, dat een duidelijk Duitsch-nationaal kenmerk droeg en hiertoe leek hem zeer een onderzoek geschikt, dat aanknoopingspunten vond met de Stassfurter kali-industrie. Bij Stassfurt, in midden-Duitschland vindt men geweldige zoutlagen, die niet alleen gewoon keukenzout, maar ook andere zeer waardevolle zouten zooals kalizouten bevatten, welke buitengewoon groote beteekenis hebben als meststof. Deze zoutlagen moeten daar ontstaan zijn door verdamping van zeewater. Maar zelfs al was daar een geheele zee van verschillende duizenden meters diepte ingedampt, dan hadden zich nog niet die dikke zoutlagen kunnen vormen, die men in Stassfurt aantreft. Men neemt daarom aan, dat zich vroeger op deze plaats een binnenzee bevond, die door een rif van de oceaan gescheiden was. Over het rif stroomde het oceaanwater voortdurend toe in dezelfde mate als het water van de binnenzee verdampte. De geconcentreerde zoutoplossing, die hierdoor ontstond, kon niet over het rif terugstroomen, daar zij soortelijk zwaarder is en dus op de bodem van de binnenzee zakte. Ten slotte ging deze zoutoplossing uitkristalliseeren en zette hierbij niet alleen keukenzout af, maar ook verschillende andere, soms zeer ingewikkelde verbindingen, zooals astrakaniet (natrium-magnesiumsulfaat), glauberiet (calcium-natriumsulfaat), glaseriet (natriumkaliumsulfaat) enz. Deze stoffen moesten natuurlijk hun oorsprong vinden in de verbindingen, die naast keukenzout in zeewater voorkomen, zij het dan ook in veel mindere mate. Van 't Hoff stelde zich nu het volgende probleem: Men kan de bij Stassfurt voorkomende zouten samengesteld denken uit enkele eenvoudige zouten als keukenzout, natriumsulfaat of glauberzout, magnesiumsulfaat of bitterzout, calciumsulfaat (gips) en nog enkele meer. Wat gebeurt er nu, als men deze stoffen in verschillende hoeveelheden te samen in water oplost en de verkregen oplossing bij constante temperatuur indampt? In welke vorm, in welke hoeveelheid | |
[pagina 43]
| |
en in welke opeenvolging scheiden zich de bij Stassfurt gevonden zouten af en welke invloed hebben de temperatuur en de druk op deze afscheiding? Dit werd het probleem, waaraan hij gesteund door dertig medewerkers (die ieder een deel bewerkten) gedurende 12 jaar (1896-1908) zijn leven wijdde en waarover hij niet minder dan 55 verhandelingen publiceerde. Samengevat werd dit alles in een geschrift: Zur Bildung der ozeanischen Salzablagerungen (De vorming van zoutafzettingen uit oceanen). Bijzonder lastig werden de onderzoekingen door het optreden van vertragingsverschijnselen. Het is zeer merkwaardig in de natuur, dat zich niet steeds direct die stoffen vormen, of die toestanden zich instellen, welke onder de gegeven omstandigheden de stabielste zijn. Zoo kan men water voorzichtig beneden nul graden afkoelen zonder dat het bevriest, of tot boven 100° verhitten zonder dat het begint te koken. Het laatste geval kan men wel eens in de huishouding merken, als men een pannetje melk op een betrekkelijk zacht brandende kachel zet. De melk raakt niet aan de kook, tot opeens de vertraging door de een of andere oorzaak opgeheven wordt en het koken met een dusdanige vaart inzet, dat de melk tegen de zolder vliegt. Ook aan ulevellen kan men het verschijnsel waarnemen. Ulevellen bestaan uit amorphe, glazige suiker. Bij kamertemperatuur is gekristalliseerde suiker stabiel en bewaart men ulevellen zeer lang, dan begint de suiker te kristalliseeren en worden de ulevellen dof en gemakkelijk fijn te drukken. En met deze vertragingsverschijnselen had Van 't Hoff bij zijn onderzoekingen in zeer sterke mate te kampen, zoodat het soms maanden duurde, voordat die verbindingen zich gevormd hadden, die zich onder die omstandigheden moesten vormen. Bij deze onderzoekingen werden tal van verbindingen kunstmatig gemaakt, die in de zoutlagen aangetroffen waren. Daaronder was ook een mineraal, dat Kubierschky in 1901 in Wilhelmshal bij Anderbeck ontdekt had. Nu worden nieuw ontdekte mineralen dikwijls naar beroemde natuuronderzoekers vernoemd en dit mineraal ontving dan ook de naam Vanthoffiet, zoodat op deze wijze Van 't Hoffs naam ook in de mineralogie vereeuwigd is. Al zijn Van 't Hoffs onderzoekingen als theoretische onderzoekingen te beschouwen, zoo zijn ze toch voor de Duitsche kali-industrie van zeer groot nut geweest. | |
[pagina 44]
| |
De Nobelprijs.In de jaren, die Van 't Hoff wijdde aan de ontraadseling van de geheimen der zoutafzetting, hadden zich tallooze eerbewijzen over hem uitgestort. In 1901 had hij een reis ondernomen naar Amerika om daar verschillende voordrachten te houden en tevens om de eeredoctoraten aan de Universiteiten te Chicago en te Harvard in ontvangst te nemen. En in hetzelfde jaar 1901 viel hem ook de hoogste wetenschappelijke onderscheiding ten deel, de Nobel-prijs. Alfred Nobel, de ontdekker van het dynamiet, was voor vijf jaar overleden en had zijn groot vermogen bestemd voor de jaarlijksche verdeeling van prijzen voor de belangrijkste onderzoekingen op wetenschappelijk gebied en voor de beste litteraire werken. Deze prijzen bedroegen honderdduizend Zweedsche kronen. Daarnaast werden ook verschillende instituten in het leven geroepen, onderzoekingslaboratoria en een bibliotheek. De Zweedsche Academie van Wetenschappen was belast met de uitvoering van Nobels testament. Maar ten gevolge van verschillende gerezen moeilijkheden, duurde het van 1896 tot 1901, voordat tot een toekenning van prijzen kon worden overgegaan. Terwijl de eerste prijs voor natuurkunde werd gegeven aan de ontdekker van de wetenschappelijk, maar ook medisch zoo belangrijke Röntgen-stralen, Röntgen, verwierf Van 't Hoff de eerste Nobel-prijs voor scheikunde, die toegekend werd. Het is op 10 December 1901, dat de eerste uitreiking van prijzen plaats vindt. In de groote zaal van de Academie voor Muziek te Stockholm zijn talrijke geleerden en kunstenaars te samen gekomen evenals vertegenwoordigers van de Koninklijke familie. Op een verhooging staat de buste van Alfred Nobel, links daarvan twee eerezuilen voor geneeskunde en litteratuur, rechts twee, die scheikunde en natuurkunde symboliseeren. Nadat de klanken van een feestouverture weggestorven zijn, houdt Boström, voorzitter van het uitvoerend comité van de Nobelstichting een rede, waarin hij een schets geeft van het leven van Nobel en de inhoud van diens testament releveert. Nu volgt een feestcantate, waarna Prof. Odhner, de voorzitter van de Zweedsche Academie van Wetenschappen de redenen uiteenzet, op grond waarvan men gemeend heeft de prijzen aan de desbetref- | |
[pagina 45]
| |
fende winnaars toe te kennen. Hierna stelt de kroonprins met eenige toepasselijke woorden de prijswinnaars hun prijs ter hand. Het is een in een album gebonden diploma, waaraan toegevoegd is een gouden penning met op de eene zijde de beeltenis van Alfred Nobel en op de andere zijde als symbolische voorstelling het beeld van Isis, dat door de wetenschap, een vrouwenfiguur, ontsluierd wordt. Bij deze voorstelling is gedacht aan het gesluierde beeld van de natuurgodin Isis, dat in vroeger eeuwen in een tempel in het oude Egypte stond en dat het geheimzinnige onbekende in de natuur personificeerde. Het aan Van 't Hoff uitgereikte diploma had ongeveer de volgende inhoud: De Koninklijke Zweedsche Academie van Wetenschappen heeft in haar zitting van 12 November 1901, volgens de voorschriften van het door Alfred Nobel op 27 November 1895 bekrachtigde testament, besloten, de prijs, die dit jaar hem toegekend moet worden ‘wien men de belangrijkste ontdekking of verbetering op het gebied der chemie verschuldigd is’ aan Een feestmaal, waaraan nog verschillende toespraken gehouden werden, besloot de dag van de plechtigheid. Volgens de statuten van de Nobel-stichting zijn de prijswinnaars verplicht binnen het jaar in het Nobel-instituut te Stockholm een voordracht te houden over de onderzoekingen, voor welke zij de prijs verworven hebben, een voorwaarde, die Van 't Hoff enkele dagen daarna nakwam. Uit de inhoud van de aan Van 't Hoff overhandigde oorkonde zien wij, dat Van 't Hoff de Nobel-prijs heeft verworven, niet voor zijn theorie van het asymmetrisch koolstofatoom, maar voor zijn theorie van de chemische dynamica en van de osmotische druk van oplos- | |
[pagina 46]
| |
singen. Ook de Zweedsche Academie van wetenschappen is van meening geweest, dat laatstgenoemde, door experimenten gestaafde theorie genialer is dan de voornamelijk door proeven van anderen bevestigde opvatting van het koolstofatoom als tetraëder. Hoe het ook zij, Van 't Hoff heeft zijn prijs verkregen voor werk uitgevoerd in Nederland, al was hij ten tijde der uitreiking niet meer in zijn vaderland woonachtig. En daarom mogen wij hem ten volle tot de Nederlandsche Nobel-prijswinnaars rekenen! Trouwens, hij was toen ook nog wettelijk een Nederlander. En dat hij in zijn hart toch ook nog een Hollander was, bewijst het volgende. Eenige weken later wedervoer hem de grootste eer, die voor een Duitscher in dat tijdvak mogelijk was; hij werd bij den Keizer ter tafel genoodigd. Van dit bezoek heeft hij eigen aanteekeningen gemaakt, die onder zijn nagelaten papieren gevonden zijn, en hierin vermeldt hij, dat hij, voordat hij ten bezoek ging, een nieuw lintje voor een orde moest koopen, aangezien het oude vuil geworden was. En daarbij noteert hij verontwaardigd: duur, klein, oranje lapje voor 60 Pfennig! Het bloed van het zuinige Hollandsche boerengeslacht uit Zwijndrechts waard, dat door zijn aderen stroomde, kwam in opstand. Al die eer is heel mooi, maar dat je dat zes en dertig centen voor zoo'n klein stukje lint kost, dat loopt toch de spuigaten uit! Echter, al was Berlijn duur, het beviel er Van 't Hoff toch zóó goed, dat een poging om hem voor de Utrechtsche Universiteit te winnen geen succes had, niettegenstaande hem zeer gunstige voorwaarden werden aangeboden. In deze tijd viel hem ook nog een eer te beurt, die alleen voor de zeer beroemden op deze aarde weggelegd is; een sigaar werd naar hem genoemd! Een van Van 't Hoffs medische studenten in Amsterdam was tot het bewustzijn gekomen, dat hij als sigarenfabrikant minder gevaarlijk voor de menschheid was dan als arts. Hij had zich dus toegelegd op de vervaardiging van rookstengels, welke met toestemming van zijn oude leermeester onder de naam ‘Van 't Hoff-sigaar’ in de handel gebracht werden. Een mooi getuigschrift betreffende de voortreffelijkheid van het product en afkomstig van den peetvader, die nooit of bijna nooit rookte, was aan ieder kistje toegevoegd. | |
Laatste jaren.Steeds omhoog voert nog de lijn van Van 't Hoffs leven. Universi- | |
[pagina 47]
| |
teiten bieden hem hun eere-doctoraten aan, geleerde gezelschappen verbinden hem aan zich als lid of eere-lid. Hij kan zich veroorloven, genoegens te smaken, die slechts weinigen deelachtig kunnen worden. Voor een tweede maal bezoekt hij Amerika en als een uitbarsting van de Vesuvius Napels opschrikt, bedenkt hij zich niet lang en reist naar deze stad om het uniek schouwspel van een vulkaan in werking waar te nemen. Geestelijk voelt hij zich van alle druk bevrijd en zijn gezondheid lijkt beter dan ooit. Maar in ieder menschenleven komt een keerpunt. En dit is bij Van 't Hoff het jaar 1906. Dan sterft zijn vertrouwdste medewerker aan longtuberculose en aan het eind van hetzelfde jaar openbaart deze moordende ziekte zich ook bij Van 't Hoff. Maanden lang ligt hij met hooge koortsen te bed en een langdurig verblijf in een sanatorium komt daarna. Herstel volgt echter en hij is in staat zijn werk over de zoutafzettingen uit oceanen af te sluiten. Een nieuw thema van onderzoek kiest hij zich: de werking van enzymen, die geheimzinnige stoffen, die de spijsverteering beheerschen, maar ook gisting en rotting. Maar het is hem niet gegeven hierbij nog belangrijke resultaten te bereiken. Zijn lichaam verzwakt, enkele uren per dag kan hij hoogstens aan zijn werk wijden en verder rust, enkel rust. Eind 1910 verlaat hij het bed in het geheel niet meer en op 1 Maart 1911 sluit hij voor goed de oogen. Volgens zijn wensch wordt zijn lijk op 5 Maart zonder bijzondere plechtigheden in het crematorium te Ohlsdorf verbrand. Ook na zijn verscheiden werd hij op verschillende wijzen geëerd. Het nieuw gebouwde laboratorium voor physische chemie te Utrecht, dat stond onder leiding van zijn leerling Ernst Cohen, was reeds bij zijn leven naar hem ‘Van 't Hoff Laboratorium’ genoemd. Nu werd een plaquette van wit marmer, dragende zijn beeltenis en vervaardigd door den bekenden Hollandschen beeldhouwer Pier Pander, hierin aangebracht. Vrienden en leerlingen hadden daarvoor de gelden verzameld. Maar men wenschte de nagedachtenis van Van 't Hoff een internationale, doch van Nederland uitgaande hulde te brengen en een kleine commissie van Amsterdamsche geleerden nam hiertoe het initiatief. Een comité ontstond, waarin talrijke binnenen buitenlandsche scheikundigen zitting hadden. Over de vorm, waarin de hulde gegoten zou worden, heerschte geen eenstemmigheid. Een deel van het comité was voor een gedenkteeken, dat ge- | |
[pagina 48]
| |
plaatst zou worden te Amsterdam, de stad, waar Van 't Hoff het wetenschappelijk werk had verricht, dat hem beroemd zou maken; anderen verklaarden meer te gevoelen voor een fonds, dat ten doel had scheikundig onderzoek te bevorderen en het comité besloot zich een tweeledig oogmerk te stellen en zoowel voor een monument als voor het fonds gelden in te zamelen, die dan ook in ruime mate toevloeiden. Een wijziging in de plannen bleek echter noodig. Terwijl in Amsterdam in wetenschappelijke kringen het plan met groote instemming begroet werd, bleek dit buiten deze kringen in geringe mate het geval te zijn. Waarschijnlijk waren de Amsterdammers niet zeer vergevensgezind en gevoelden zij nog rancune over de wijze, waarop Van 't Hoff uit Amsterdam weggegaan was. In elk geval, het leek het comité niet juist om onder deze omstandigheden het standbeeld te Amsterdam op te richten en het wendde daarom de blik naar Van 't Hoffs geboortestad Rotterdam, waar haar voorstellen, ook bij autoriteiten en in de kringen der burgerij met groote sympathie en met enthousiasme ontvangen werden. Toch wilde het comité eveneens in Amsterdam iets blijvends tot stand brengen en zij liet daarom den Heer Charles van Wijk een bronzen plaquette vervaardigen, ten einde deze in de groote collegezaal van het door Van 't Hoff gebouwde scheikundig laboratorium aan te brengen hetgeen in December 1913 zonder officieele plechtigheden geschiedde. De Heer van Wijk ontving tevens de opdracht voor het monument te Rotterdam, hetwelk geplaatst werd op het plein voor de Hoogere Burgerschool aan de 's-Gravendijkwal. Door de wereldoorlog vond de onthulling als een strikt nationale gebeurtenis plaats op 17 April 1915. Het monument, ik volg hier grootendeels de beschrijving door den beeldhouwer zelve gegeven, is uit grijs Beyersch graniet, in ongepolijste staat, opgebouwd. Op het voorvlak van het piedestal van de figuur van Van 't Hoff leest men: VAN 'T HOFF en daaronder: physicam chemiae adiunxit Op de beide zijvlakken zijn belangrijke data uit Van 't Hoffs leven en zijn gewichtigste werken vermeld; men leest er rechts: | |
[pagina 49]
| |
JACOBUS HENRICUS VAN 'T HOFF en links: Voorstel tot uitbreiding der in de scheikunde Aan de achterzijde van het piedestal is een basrelief in brons aangebracht, dat Van 't Hoffs privélaboratorium in het oude chemische laboratorium aan de Groenburgwal te Amsterdam voorstelt. Het standbeeld is geflankeerd door twee symbolische, in kalksteen gehouwen vrouwenfiguren, waarvan de een met haar opgeheven hand en omhoog gerichte blik de verbeeldingskracht uitdrukt, terwijl de andere in zichzelve gekeerde figuur de rede voorstelt. De hoofdfiguur is het beeld van Van 't Hoff, in brons op tweemaal de levensgrootte. Het vertoont den geleerde zittend, de handen op de knieën. De rol, die Van 't Hoff in de hand houdt, duidt op de vele voordrachten, welke hij niet uitsluitend voor zijn leerlingen hield, maar vrijwel over de geheele wereld uitsprak. Naast de oprichting van een monument kon ook het andere doel van het comité verwezenlijkt worden. Op 28 Juni 1913 werd te Amsterdam het ‘Van 't Hoff-fonds’ gesticht met als doel: het ver- | |
[pagina 50]
| |
leenen van subsidie aan beoefenaars der scheikunde, zonder onderscheid van nationaliteit, tot het uitvoeren van wetenschappelijke onderzoekingen op het gebied der zuivere of toegepaste scheikunde. Beide, zoo verschillende vormen van hulde bestaan ook nu nog en zij houden de herinnering vast aan een groot geleerdeGa naar voetnoot*), wien het gegeven was een nieuwe tak van wetenschap, de physische chemie, te gronden en van wien de Latijnsche spreuk terecht zegt: ‘PHYSICAM CHEMIAE ADIUNXIT’. |
|

