Van Stevin tot Lorentz
(1990)–A.J. Kox–Portretten van achttien Nederlandse natuurwetenschappers
[pagina 199]
| |
16 Jacobus H. van 't Hoff 1852-1911H.A.M. Snelders
 De eerste Nederlander die de Nobelprijs mocht ontvangen, Jacobus Henricus van 't Hoff werd op 30 augustus 1852 in Rotterdam geboren als het derde van zeven kinderen uit het huwelijk van de arts Jacobus Henricus van 't Hoff en Alida Jacoba Kolff. In 1867 ging hij naar de vierde klas van de Rotterdamse Hoogere Burgerschool, een onderwijsinstelling, die kort tevoren door minister Thorbecke in het leven was geroepen. Reeds in 1869 haalde hij het einddiploma, dat tevens toelating tot Polytechnische School te Delft gaf. Daar legde hij in 1871 met goed gevolg het examen van technoloog af. Zijn belangstelling ging echter meer uit naar de theoretische zijde van de scheikunde. In Delft bestudeerde hij zelfstandig het differentiaal- en integraalrekenen en raakte hij geïnteresseerd in wijsbegeerte. Hij verdiepte zich in Auguste Comtes Cours de philosophie positive, William Whewells History of the Inductive Sciences en Hippolyte Taines De l'Intelligence en kwam onder grote bekoring van de gedichten van lord Byron. Om zijn studies in de zuivere wetenschap aan de universiteit te kunnen vervolgen, moest hij een admissie-examen in Grieks en Latijn afleggen. Hij kreeg van de minister van Binnenlandse Zaken echter vrijstelling van dat examen, zodat hij in september 1871 in Leiden kon gaan studeren. Hier legde hij zich vooral toe op de studie van de wiskunde. Hij werkte van de herfst van 1872 tot de lente van 1873 op het beroemde chemische laboratorium van August Kekulé in Bonn en legde in december 1873 het doctoraalexamen scheikunde af aan de universiteit van Utrecht. Begin 1874 vertrok hij naar | |
[pagina 200]
| |
Parijs om verder te studeren bij de chemicus Adolphe Wurtz, die vooral naam had gemaakt met zijn onderzoek van de organische ammoniakverbindingen. Op diens laboratorium ontmoette hij de vijf jaar oudere Joseph Achille le Bel uit Peckelbrunn in de Elzas, die onafhankelijk van hem een theorie zou publiceren voor de verklaring van optische isomerie gebaseerd op stereochemische beschouwingen. In de zomer van 1874 keerde Van 't Hoff terug naar ons land en in september van hetzelfde jaar publiceerde hij zijn theorie van het asymmetrisch koolstofatoom, waarmee de ontwikkeling van de stereochemie een aanvang nam. Op 22 oktober 1874 promoveerde hij bij Eduard Mulder in Utrecht op een onbelangrijke dissertatie: Bijdrage tot de kennis van cyanazijnzuur en malonzuur. Het kostte Van 't Hoff veel moeite een betrekking te vinden. Met het solliciteren als leraar had hij geen succes en hij bleef in Utrecht met privaatlessen in zijn onderhoud voorzien. Een deel van zijn tijd besteedde hij aan onderzoekingen in het chemisch laboratorium van de Utrechtse universiteit en in 1875 verscheen zijn boekje La Chimie dans l'espace. Pas in 1876 werd hij benoemd tot leraar aan 's Rijks Veeartsenijschool in Utrecht. Zijn academische loopbaan begon in 1877 met zijn benoeming tot lector in de theoretische en fysische chemie aan de Universiteit van Amsterdam, waar hij van 1878 tot 1896 professor in chemie, mineralogie en geologie en hoofd van het chemisch laboratorium was. De benoeming had hij ongetwijfeld te danken aan Jan Willem Gunning, hoogleraar in chemie en farmacie in Amsterdam, met wie hij sterk bevriend was geraakt. In de inaugurele oratie: Verbeeldingskracht in de wetenschap (11 oktober 1878) verdedigde Van 't Hoff dat voor de studie van de natuurwetenschappen zowel waarneming als verbeelding noodzakelijk is. Uit levensbeschrijvingen van ruim 200 wetenschappers concludeerde hij dat de belangrijksten onder hen door hun fantasie geleid werden. Enige maanden later (27 december 1878) trad hij in het huwelijk met zijn Rotterdamse jeugdvriendin Johanna Francisca Mees, uit welk huwelijk twee zoons en twee dochters werden geboren. Van 't Hoffs Amsterdamse jaren vormen het hoogtepunt van zijn wetenschappelijke loopbaan. Experimenten ter ondersteuning van zijn theorie van het asymmetrisch koolstofatoom deed hij nauwelijks. Zijn belangstelling was gericht op de vraag wat er onder bepaalde omstandigheden na een bepaalde tijd zal gebeuren als men verschillende chemische stoffen bij elkaar brengt. Hiermee werd hij een van de belangrijkste grondleggers van een nieuwe wetenschap, de fysische chemie, hetgeen na zeven jaar resulteerde in het boek: Études de dynamique chimique (1884). Van 1885 tot 1890 publiceerde hij de resultaten van zijn onderzoekingen over de osmotische druk waarin de analogie tussen verdunde oplossingen en | |
[pagina 201]
| |
gassen een grote rol speelde. Van 't Hoff werd door zijn publikaties steeds beroemder. In 1887 kreeg hij een uitnodiging voor een hoogleraarschap in Leipzig. Toen dit bekend werd, probeerde men van alle kanten hem te overreden zijn vaderland niet te verlaten. De Amsterdamse gemeenteraad bood hem een nieuw chemisch laboratorium aan dat in 1891 was voltooid op de hoek van de Nieuwe Prinsengracht en de Roetersstraat, maar dat kon niet voorkomen dat Van 't Hoff in 1896 naar Berlijn vertrok, waar hij werd benoemd tot lid van de Pruisische Academie van Wetenschappen en hoogleraar aan de Berlijnse universiteit. Hij publiceerde zijn colleges als Vorlesungen über theoretische und physikalische Chemie (1898-1900, 3 delen) en Die chemischen Grundlehren nach Menge, Mass und Zeit (1912). Met Wilhelm Ostwald stichtte hij het Zeitschrift für physikalische Chemie, waarvan de eerste aflevering in februari 1887 verscheen. De wetenschappelijke verdiensten van Van 't Hoff werden niet alleen erkend door de toekenning van de Nobelprijs voor scheikunde (1901), maar ook door zijn benoeming tot lid van de Koninklijke Akademie van Wetenschappen (1885). Hij ontving eredoctoraten van Harvard en Yale (1901), Victoria University of Manchester (1903) en van de Universiteit van Heidelberg (1908); hij ontving de Davy Medaille van de Royal Society of London (1893) en de Helmholtz Medaille van de Pruisische Academie van Wetenschappen (1911). Hij werd benoemd tot Chevalier de la Légion d'Honneur (1894), senator van het Kaiser-Wilhelm Gesellschaft (1911) en hij was lid van de Koninklijke Academie van Wetenschappen in Göttingen (1892), de Chemical Society of London (1898), de American Chemical Society (1898) en de Académie des Sciences (1905). Op 1 maart 1911 stierf hij aan longtuberculose. Zijn lichaam werd op 5 maart gecremeerd en de as werd bijgezet op de begraafplaats van Berlin-Dahlem. Op 5 september 1874 publiceerde Van 't Hoff een slechts twaalf bladzijden tellende brochure getiteld: Voorstel tot uitbreiding der tegenwoordig in de scheikunde gebruikte structuurformules in de ruimte; benevens een daarmee samenhangende opmerking omtrent het verband tussen optisch actief vermogen en chemische constitutie van organische verbindingen. Hierin past hij het tetraëdermodel toe voor de verklaring van zowel de optische activiteit van organische verbindingen, als voor de structuur van organische verbindingen met een twee- en een drievoudige binding. Vrijwel gelijktijdig en onafhankelijk van onze landgenoot publiceerde de Franse chemicus Joseph Achille le Bel (1847-1930) eveneens een verhandeling over dit thema als ‘Sur les relations qui existent entre les formules atomiques des corps organiques et le pouvoir de leurs dissolutions’ in het Bulletin de la Socitété Chimique de France.Ga naar eind1 Van 't Hoff kwam tot zijn theorie via de opvattingen van zijn leermeester Kekulé over de vierwaardigheid van het koolstofatoom (dat wil zeggen dat een koolstofatoom vier bindingsmogelijkheden heeft) en de mogelijkheid | |
[pagina 202]
| |
van de koolstof-koolstofketenvorming (1858), alsmede door een drietal artikelen van de Duitse chemicus Johannes Wislicenus (1873) over de structuur van de drie isomere melkzuren, waaraan hij slechts twee formules kon toekennen:Ga naar eind2  Wislicenus komt daarin tot de conclusie dat het enige verschil tussen de twee optisch actieve vormen van melkzuur (de linker formule) moet bestaan in een bijzondere ruimtelijke rangschikking van hun atomen. Van 't Hoff had deze publikaties bestudeerd in de Utrechtse universiteitsbibliotheek. Op voorstel van Christopher Hendrik Diederik Buys Ballot, Van 't Hoffs natuurkundehoogleraar in Utrecht, werd het Voorstel spoedig in het Frans vertaaldGa naar eind3 en het jaar erop publiceerde Van 't Hoff zijn nieuwe opvattingen in uitgebreide vorm als La chimie dans l'espace. De revolutionaire ideeën trokken echter weinig aandacht van de scheikundige wereld tot Wislicenus aan Van 't Hoff toestemming vroeg voor een Duitse vertaling door een van zijn leerlingen, Felix Herrmann. De vertaling verscheen in 1877 als Die Lagerung der Atome im Raume. In 1887 publiceerde Van 't Hoff zijn Dix années dans l'histoire d'une théorie, waarin hij opmerkt dat Le Bel onafhankelijk tot dezelfde theorie is gekomen, zij het in een meer abstracte vorm uitgaande van algemene beschouwingen over moleculaire asymmetrie.Ga naar eind4 Zowel Van 't Hoff als Le Bel toonden aan dat de rangschikking van vier verschillende éénwaardige groepen aan de hoekpunten van een regelmatiger tetraëder (door Van 't Hoff gedefinieerd als een asymmetrisch koolstofatoom, met andere woorden: een koolstofatoom ‘gebonden aan vier onderling verschillende univalente groepen’) twee spiegelbeeldstructuren oplevert. Het laatste is een vereiste voor het bestaan van optische isomeren, zoals Louis Pasteur al in 1860 had ingezien toen hij vond dat optische rotatie het gevolg is van asymmetrie in het molecuul zelf. Van 't Hoff signaleert in zijn Voorstel dat met de toen gebruikte tweedimensionale structuurformules niet alle bekende isomeriegevallen zijn te verklaren. In het eerste gedeelte van het Voorstel behandelt hij - aan de hand van een groot aantal voorbeelden (wijnsteenzuur, melkzuur, suikers, kamfer enz.) - het verband tussen het asymmetrisch koolstofatoom en de optische activiteit (d.w.z. het vermogen om het polarisatievlak van een bundel lineair gepolariseerd licht die door zo'n stof valt over een bepaalde hoek te draaien). De voorstelling van Van 't Hoff over het asymmetrisch koolstofatoom gaf een verklaring voor het voorkomen van een groot aantal isomeriegeval- | |
[pagina 203]
| |
len, welke met de in die tijd gebruikte twee-dimensionale structuurformules niet konden worden begrepen. Tevens gaf hij het bestaan van een verband tussen optische activiteit en de aanwezigheid van een asymmetrisch koolstofatoom in het molecuul aan. Ook het verband tussen het asymmetrisch koolstofatoom en het aantal isomeren werd door hem besproken, hoewel hij pas in La chimie dans l'espace aantoonde dat het aantal mogelijke isomeren van een verbinding met n ongelijke asymmetrische koolstofatomen 22 bedraagt, terwijl hij ook afleidde hoe het aantal isomeren afneemt als een of meer asymmetrische koolstofatomen equivalent zijn. In gevallen dat een verbinding optische activiteit vertoont, maar een symmetrische formule bevat, postuleerde Van 't Hoff dat er óf een fout in de formule was óf dat er een optisch actieve onzuiverheid in de verbinding moest zitten. In 1894 gaf hij de later bevestigde opvatting dat het voorkomen van optisch actieve verbindingen in de natuur het gevolg kan zijn van de werking van circulair gepolariseerd licht in de atmosfeer op optisch inactieve stoffen. Van 't Hoffs Voorstel bevat echter meer dan een verklaring van de optische isomerie van organische verbindingen. Hij wist met zijn tetraëdermodel ook de isomerie van etheen- en ethynderivaten te verklaren. Ondanks de toezending van La Chimie dans l'espace, alsmede van uit karton vervaardigde tetraëders en andere structuren aan een aantal bekende chemici - Adolph Baeyer in Straatsburg, Alexander Butlerov in St. Petersburg, Louis Henry in Leuven, August von Hofmann in Berlijn, August Kekulé in Bonn, Edward Frankland in Londen, Johannes Wislicenus in Straatsburg, Adolphe Wurz en Marcellin Berthelot in Parijs - trokken de ideeën van onze landgenoot nauwelijks de aandacht.Ga naar eind5 Hij kreeg waarderende brieven van Walther Spring, Wurtz en Henry, maar ze deden geen poging de theorie te bediscussiëren of te bekritiseren. Baeyer beoordeelde de theorie zeer gunstig, maar het valt te betwijfelen of Van 't Hoff hiervan snel op de hoogte is gekomen. Hoewel Hans Landolt in 1877 geen voorbeeld kon aanwijzen dat in strijd was met de hypothese van Van 't Hoff, was Berthelot er zonder meer tegen, omdat hij meende dat er optisch actieve stoffen waren zonder asymmetrisch koolstofatoom in het molecuul, zoals barnsteenzuur en styreen. De felste en meest afbrekende kritiek kwam in mei 1877 van Hermann Kolbe, die de theorie van onze landgenoot als ‘Phantasie-Spielereien’ beschouwde, die ‘ganz und gar das thatsächlichen Bodens entbehren und dem nüchternen Forscher rein unverständlich sind’.Ga naar eind6 De meeste chemici stonden sceptisch tegenover de theorie, omdat zij het niet eens konden zijn met het feit dat Van 't Hoff de fysische realiteit van atomen en moleculen had aangenomen. Kekulé ging dan ook niet verder dan de theorie een bruikbare hypothese te noemen. Hij stond, als vele vooraanstaande chemici uit die tijd, sceptisch tegenover het werkelijk bestaan van | |
[pagina 204]
| |
atomen en moleculen. Daarbij kwam dat men de tetraëdertheorie strijdig met de fysische wetten achtte. In het bijzonder het postulaat dat de vier bindingen van het koolstofatoom a priori gericht zijn naar de hoekpunten van een regelmatige tetraëder, beschouwde men in strijd met de wetten van de toenmalige fysica. De richting van een aantrekkende kracht wordt bepaald door de plaats van het aangetrokken lichaam, terwijl de vier valentierichtingen in Van 't Hoffs tetraëder daarvan onafhankelijk zijn. Ook het feit dat er vier valenties in bepaalde richtingen van het atoom uitgaan, vond men onaanvaardbaar. Op Le Bels opvattingen daarentegen werd nauwelijks kritiek geuit. Diens abstracte geometrische beschouwingen stonden los van een atoommodel. Wat de verklaring van de optische isomerie betreft, kwam hij tot dezelfde resultaten als onze landgenoot. Omdat hij geen tetraëdermodel als uitgangspunt nam, was hij het echter niet eens met Van 't Hoffs model voor etheenderivaten. Volgens Le Bel was het helemaal niet zeker dat hier geen optische isomerie zou optreden; hij heeft er dan ook jarenlang naar gezocht. In ons land vond het Voorstel eveneens weinig belangstelling. De Groningse hoogleraar Rudolph Sicco Tjaden Modderman vond ze te voorbarig (1874). Alleen Gunning en Buys Ballot gingen serieus in op Van 't Hoffs nieuwe theorie. Gustav Jacob Wilhelm Bremer voerde met Van 't Hoff een briefwisseling over diens hypothese en maakte er gebruik van in zijn dissertatie over het rechtsdraaiend appelzuur (1875).Ga naar eind7 Van 't Hoff nam dus als uitgangspunt voor zijn theorie het werkelijk bestaan van atomen en moleculen aan. Merkwaardigerwijs had een jaar eerder een andere landgenoot hetzelfde gedaan, namelijk Johannes Diderik van der Waals, die in zijn dissertatie Over de continuïteit van den gas- en vloeistoftoestand (1873) een uitbreiding van de kinetische gastheorie gaf, die leidde tot het opstellen van de toestandsvergelijking waarin de onderlinge aantrekkingskracht en het eigen volume van de moleculen in rekening werden gebracht. De sceptische houding tegenover de ideeën van Van 't Hoff duurde niet lang. Binnen luttele jaren werden zijn opvattingen aan veel voorbeelden toegelicht en uitgebreid. Van 't Hoff zelf zei in een lezing voor de Universiteit van Chicago op 20 juni 1901: ‘By means of stereochemistry so much at least was accomplished that, the real existence of the atoms being assumed, not only was their mode of union described but also their relative position in the molecule was determined.’Ga naar eind8 In 1884 verschenen Van 't Hoffs Études de dynamique chimique waarin hij allereerst de snelheid van een chemische reactie onderzoekt. Hij was op dit onderwerp gekomen toen hij bij zijn stereochemische onderzoekingen bij toeval de ontleding van dibroombarnsteenzuur bij 100 °C waarnam: COOH.CHBr.CHBr.COOH ⇄ HBr + COOH.CH = CBr.COOH Hij zag in dat hij hiermee de snelheid van chemische reacties kon onder- | |
[pagina 205]
| |
zoeken. De betrokken reactie herkende hij als unimoleculair (eerste-ordereactie), waarbij de hoeveelheid die per tijdseenheid wordt omgezet, evenredig is met de totale hoeveelheid en onafhankelijk van de concentratie. Als voorbeeld van een bimoleculaire (tweede-orde) reactie onderzocht hij met zijn leerling L.C. Schwab in 1883 de verzeping van monochloorazijnzuur: CH2CICOONa + NaOH ⇄ NaCI + CH2OH.COONa Van 't Hoff vond hierbij het (positieve) zouteffect van het gevormde NaCI en verklaarde afwijkingen in meer geconcentreerde oplossingen als gevolg van het eigen volume van de moleculen. Op fraaie wijze bepaalde hij de reactie-orden van een aantal verbindingen, waarbij hij zich terdege van de storende invloeden door activiteitsfactoren, reactiemilieu en beweging van de moleculen bewust was. Uit de invloed van de temperatuur op de snelheid van bovengenoemde reacties van dibroombarnsteenzuur en van monochloorazijnzuur leidde Van 't Hoff zijn belangrijke thermodynamische formule af welke het verband aangeeft tussen de absolute temperatuur T en de snelheidsconstante K: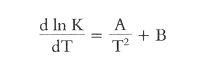 waarin A en B temperatuursafhankelijke factoren zijn. (A werd later activeringsenergie genoemd.) Hij maakte bij zijn beschouwing gebruik van de voorstelling van het chemisch evenwicht als resultaat van twee tegengestelde reacties en voerde de dubbele pijl in als symbool van een dynamisch chemisch evenwicht. In het tweede gedeelte van de Études behandelde Van 't Hoff het chemisch evenwicht. Zonder afleiding vinden we hier zijn algemene vergelijking voor de invloed van de absolute temperatuur T op de evenwichtsconstante K: 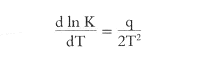 waarin q de reactiewarmte bij constant volume voorstelt. In 1886 toonde hij aan dat de zgn. Clausius-Clapeyron-vergelijking, die het verband aangeeft tussen de temperatuurscoëfficiënt van de dampspanning tot de reactiewarmte en volumeverandering, in algemene vorm uit bovenstaande vergelijking kan worden afgeleid. Van 't Hoff past zijn formule toe op homogene en heterogene evenwichten, op ‘gecondenseerde’ systemen (waarin geen enkele component een variabele concentratie heeft) en op ‘fysische’ evenwichten, dat wil zeggen toestandsverbeteringen (zoals ijs ⇄ water). Voorts formuleert hij het bekende principe van het beweeglijke evenwicht, zij het in de beperkte zin dat het evenwicht bij temperatuursdaling zich verplaatst naar de kant van het systeem, dat gevormd wordt onder vrijkomen van warmte: ‘Tout équilibre | |
[pagina 206]
| |
entre deux états différents de la matière (systèmes) se déplace, par un abaissement de la température, vers celui des deux systèmes dont la formation développe de la chaleur.’Ga naar eind9 In 1884 formuleerde Le Châtelier het beginsel in algemene vorm inclusief de invloed van de druk. In het gedeelte van de Études dat over de affiniteit van de chemische verbindingen gaat, formuleert Van 't Hoff de arbeid A (= de maximale externe arbeid van het systeem) als maat van de affiniteit bij de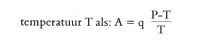 waarin P de absolute temperatuur is van het overgangspunt, q het warmteeffect en T de absolute temperatuur. Veel belangstelling ondervonden de Études aanvankelijk niet. Het was geen leerboek noch een zuiver wetenschappelijk werk over een bepaald probleem terwijl talrijke nieuwe formules worden medegedeeld en toegepast zonder afleiding. Die vinden we in artikelen van Van 't Hoff in de Archives Néerlandaises (1885) en de Verhandelingen van de Zweedse Academie van Wetenschappen (1886). Van belang was vooral het artikel ‘L'Équilibre chimique dans les systèmes gazeux, ou dissous à l'état dilué’ (1886),Ga naar eind10 waarin Van 't Hoff zijn theorie van de verdunde oplossingen beschrijft. De Baselse botanicus Pfeffer had in 1877 een experiment gedaan waarin hij een poreuze pot, voorzien van een semi-permeabele wand, in water plaatste terwijl zich in de pot een suikeroplossing bevond. Sloot hij de pot van boven hermetisch met een stop af en stak hij daardoor een glazen buis met een nauwe opening, dan nam hij waar dat de suikeroplossing langzaam in de buis opsteeg om, na een zekere hoogte te hebben bereikt, niet verder te stijgen. De stijging in de buis is toe te schrijven aan het binnendringen van water door de semi-permeabele wand. Pfeffer vond dat als de vloeistof niet meer stijgt, de hydrostatische druk van de vloeistofzuil evenwicht maakt met de osmotische druk van de suikeroplossing in de poreuze cel. Van 't Hoff paste de wetten van de thermodynamica toe op het verschijnsel en kwam tot het verrassend eenvoudige resultaat dat de wetten van Gay-Lussac, Boyle en Avogadro voor verdunde gassen eveneens voor verdunde oplossingen van vaste vloeistoffen gelden indien men voor het begrip gasdruk dat van osmotische druk in de plaats zet. Tevens kon hij hiermee de toen recent door François Raoult ontdekte verschijnselen van kookpuntsverhoging en vriespuntsdaling verklaren. Evenmin als zijn stereochemische opvattingen ondervond Van 't Hoffs theorie van de verdunde oplossingen in het begin veel belangstelling. De nieuwe opvattingen werden vooral verspreid door het Zeitschrift für physikalische Chemie, dat in 1887 door Van 't Hoff en Wilhelm Ostwald werd opgericht. | |
[pagina 207]
| |
Voor de analogie die bestaat tussen gassen en oplossingen gaf Van 't Hoff de algemene uitdrukking pV = iRT (p = druk, V = volume, R = gasconstante en T = absolute temperatuur). De coëfficiënt i is een empirische factor die de afwijkingen verdisconteert als gevolg van de elektrolytische dissociatie. Voor binaire elektrolyten (NaCI, KCI) vond hij in verdunde oplossingen waarden voor i van 1,7 tot 1,9; zowel uit de vriespuntsdaling als uit de dampdrukverlaging. Ook de isotonische coëfficiënt, afgeleid uit gegevens over de turgor respectievelijk van Hugo de Vries met plantencellen en van Donders en Hartog Jacob Hamburger met rode bloedlichaampjes, leverden zeer goede overeenkomstige waarden voor i. Het was Svante Arrhenius die in i de getallen herkende die hij uit het elektrisch geleidend vermogen had afgeleid voor het aantal ionen waarin de elektrolyt zich splitst. De i van Van 't Hoff was daardoor de voorloper van de activiteitsfactoren want hij bracht de i ook in toepassing bij de berekening van evenwichten en van reactiesnelheden. De theorie van de elektrolytische dissociatie van Arrhenius vond in Van 't Hoff dan ook onmiddellijk een aanhanger. In zijn Amsterdamse jaren bleef Van 't Hoff zich met zijn fysiochemische studies bezighouden, daarbij geholpen door een aantal leerlingen (Johan Eykman, Pieter Frowein, Arnold Holleman, Ernst Cohen en Willem Jorissen) en met buitenlanders die bij hem kwamen studeren (Arrhenius en Wilhelm Meyerhoffer). Daarnaast hield hij zich bezig met onderzoekingen over de vorming, splitsing en omzetting van dubbelzouten resulterend in zijn Vorlesungen über Bildung und Spaltung von Doppelsalzen (1897). Na zijn overlijden verscheen het voor de Duitse zoutindustrie belangrijke werk: Untersuchungen über die Bildungsverhältnisse der ozeanischen Salzablegerungen, insbesondere der Stassfurter Salzlagern (1912). In Berlijn stelde Van 't Hoff zich tot doel iets te ondernemen dat zijn nieuwe land tot bijzonder nut kon zijn. Bij Stassfurt vindt men geweldige zoutlagen, die behalve NaCI ook andere waardevolle zouten bevatten, waaronder voor de kunstmestindustrie belangrijke kaliumzouten. Deze zoutlagen zijn ontstaan door verdamping van zeewater. Van 't Hoff stelde zich nu het volgende probleem: men kan de bij Stassfurt voorkomende zouten samengesteld denken uit eenvoudige zouten als NaCI, Na2SO4, MgSO4, CaSO4, en dergelijke. Wat gebeurt er als men deze stoffen in verschillende hoeveelheen samen in water oplost en de verkregen oplossing bij constante temperatuur indampt? In welke vorm, in welke hoeveelheid en in welke opeenvolging scheiden zich de zouten af en welke invloed hebben de temperatuur en de druk op deze afscheiding? Dit belangrijke theoretische onderzoek deed hij gedurende twaalf jaar (1896-1908) met een dertigtal medewerkers en dit resulteerde in het tweedelige Zur Bildung der ozeanischen Salzablagerungen (2 delen, 1905, 1909). De scheikunde dankt aan Van 't Hoff fundamentele bijdragen over stereo- | |
[pagina 208]
| |
chemie, de theorie van de verdunde oplossingen en de ontwikkelingen van de chemische kinetica. Hij heeft de fysische chemie gesticht als een onafhankelijke discipline. Toen in 1889 zijn studenten hem een portretreliëf aanboden, werd daarin een zin gebeeldhouwd die zijn levenswerk het kortst en krachtigst aangeeft: Physicam chemiae adiunxit, (hij voegde de natuurkunde met de scheikunde samen). |
|

